Inmunología Humana
-
INTRODUCCIÓN AL SISTEMA INMUNE HUMANOIntroducción. Conceptos básicos10 Temas
-
Introducción Inmunología
-
Funciones sistema inmune y barreras de defensa
-
Inmunidad innata vs adaptativa
-
Respuesta humoral vs celular
-
Respuesta adaptativa primaria vs secundaria
-
Características de la respuesta inmunitaria adaptativa
-
Concepto de antígeno
-
La respuesta inmunitaria específica es clonal
-
Revisión de los componentes del sistema inmunitario
-
Patología general del sistema inmunitario
-
Introducción Inmunología
-
Células del sistema inmune y diferenciación celular6 Temas
-
Hematopoyesis
-
Las células sanguíneas (I): Granulocitos y Mastocitos
-
Las células sanguíneas (II): Plaquetas, Eritrocitos, Monocitos y Macrófagos
-
Las células sanguíneas (III): Linfocitos (T y B), Células plasmáticas y LGL (Linfocitos NK)
-
Las células sanguíneas (IV): Células dendríticas y proporciones relativas de los tipos celulares
-
Funciones y gestión de receptores para antígenos
-
Hematopoyesis
-
Tejidos del sistema inmune: órganos linfoides 1º y 2º3 Temas
-
Células y mecanismos de la inmunidad innata (I): macrófagos, receptores y mecanismos efectores5 Temas
-
Células y mecanismos de la inmunidad innata (II): linfocitos NK, receptores y mecanismos efectores4 Temas
-
MOLÉCULAS IMPLICADAS EN EL RECONOCIMIENTO DE ANTÍGENOEl receptor de antígeno del linfocito B6 Temas
-
Inmunoglobulinas (I): Formas en la naturaleza, estructura y dominio básico
-
Inmunoglobulinas (II): Clases, formas, variabilidad y tejidos
-
Inmunoglobulinas (III): Enlaces antígeno-anticuerpo y funciones
-
Inmunoglobulinas (IV): Receptores para inmunoglobulinas
-
Inmunoglobulinas (V): Procesamiento de RNA, receptor del linfocito B, complejo co-receptor y activación célula B
-
Inmunoglobulinas (VI): Desarrollo / Diferenciación células B
-
Inmunoglobulinas (I): Formas en la naturaleza, estructura y dominio básico
-
El receptor de antígeno del linfocito T4 Temas
-
Mecanismos de generación de la diversidad de linfocitos T y B9 Temas
-
Genes para las cadenas pesadas y ligeras: Diversidad potencial
-
Reordenamiento de los genes
-
Mecanismos de amplificación de la diversidad
-
Expresión de las inmunoglobulinas en el BCR
-
Maduración de los linfocitos B
-
La cooperación T-B
-
Anomalías/Problemas en el proceso (CLÍNICA)
-
Maduración de los linfocitos B
-
Variabilidad en el repertorio del TcR en linfocitos T
-
Genes para las cadenas pesadas y ligeras: Diversidad potencial
-
El complejo principal de histocompatibilidad (I): estructura proteica, genética y nomenclatura3 Temas
-
El complejo principal de histocompatibilidad (II): Procesamiento y presentación de antígeno, polimorfismo y aplicaciones clínicas5 Temas
-
MOLÉCULAS ACCESORIAS DE LA RESPUESTA INMUNEEl sistema del complemento y sus receptores (I): vía clásica y vía alternativa4 Temas
-
El sistema del complemento y sus receptores (II): vía de las lectinas, vía lítica y regulación3 Temas
-
Moléculas implicadas en la comunicación intercelular (I): citocinas y sus receptores5 Temas
-
Moléculas implicadas en la comunicación intercelular (II): moléculas de adhesión y sus ligandos3 Temas
-
EL SISTEMA INMUNE EN ACCIÓN BLOQUEGeneración de linfocitos T efectores4 Temas
-
Generación de linfocitos B efectores7 Temas
-
Sistema Inmune asociado a mucosas (MALT)9 Temas
-
Introducción MALT
-
Estructura del tejido linfoide asociado a la mucosa intestinal
-
Recirculación y migración selectiva de linfocitos al intestino
-
Barrera epitelial intestinal: Función Inmunológica
-
Receptores para el reconocimiento de patrones moleculares
-
Inmunoglobulinas Poliméricas: IgM + IgA
-
Vías de entrada del antígeno en el intestino
-
Diferenciación de los linfocitos T efectores MALT
-
Tolerancia Oral ante antígenos solubles
-
Introducción MALT
-
La respuesta inmune (I): inmunidad innata e inflamación aguda8 Temas
-
Barreras no específicas frente a infección por microorganismos patógenos
-
Principales leucocitos que paticipan en las inmunidad innata
-
La rección inflamatoria
-
Inflamación aguda
-
Sucesos del proceso inflamatorio
-
Citocinas producidas por macrófagos: efectos locales y sistémicos
-
Efectos de las citocinas en la inmunidad innata
-
Proteínas de fase aguda
-
Barreras no específicas frente a infección por microorganismos patógenos
-
La respuesta inmune (II): mecanismos de la inmunidad específica8 Temas
-
La respuesta inmune (III): respuesta frente a virus, bacterias y hongos, protozoos y helmintos9 Temas
-
Principales enfermedades infecciosas mortales
-
Patógenos infecciosos
-
Respuestas frente a bacterias extracelulares
-
Respuesta frente a bacterias intracelulares
-
Proceso de fagocitosis
-
Respuestas frente a protozoos y helmintos
-
Ciclo vital del plasmodium
-
Respuestas inmunitarias frente a virus
-
Mecanismos de evasión inmunitaria. Virales y bacterianos.
-
Principales enfermedades infecciosas mortales
-
REGULACIÓN e INTRODUCCIÓN A LA INMUNOPATOLOGÍARegulación de la respuesta inmune (I): regulación por moléculas8 Temas
-
Regulación de la respuesta inmune: Introducción
-
Regulación por moléculas: el complemento (I)
-
Proteínas reguladoras del complemento y proceso de regulación (II)
-
Proceso de regulación por complemento (III)
-
Regulación de los anticuerpos preformados
-
Regulación por anticuerpos: Redes idiotípicas
-
Regulación por moléculas de linfocitos T
-
Regulación a nivel bioquímico: ITAM frente a ITIM
-
Regulación de la respuesta inmune: Introducción
-
Regulación de la respuesta inmune (II): regulación por células y sistemas4 Temas
-
El sistema inmune a lo largo del ciclo vital: Inmunosenescencia6 Temas
-
Introducción a la inmunopatología13 Temas
-
Conceptos básicos
-
Inmunodeficiencias
-
Las Inmunodeficiencias (II): Déficits de Complemento
-
Las Inmunodeficiencias (III): Déficits de citocinas en receptores
-
Las Inmunodeficiencias (IV): Déficits de TLR's
-
Las Inmunodeficiencias (V): Déficits de función fagocitaria
-
Las Inmunodeficiencias (VI): Déficit de linfocitos B
-
Las Inmunodeficiencias (VII): Déficits de linfocitos T
-
Inmunodeficiencias primarias (IDP's): Clínica y Diagnóstico
-
Hipersensibilidades
-
Autoinmunidad
-
Trasplantes. Rechazo
-
Inmunidad frente a tumores
-
Conceptos básicos
-
Introducción a la Inmunoterapia8 Temas
-
Vacunas (I): Bases inmunológicas
-
Vacunas (II): Tipos de vacunas
-
Inmunoterapia frente a enfermedades autoinmunes
-
Anticuerpos monoclonales en la terapia del cáncer
-
Otras estrategias anti-tumorales
-
Tratamiento “clásico” de la patología alérgica
-
Inmunoterapia en el trasplante de órganos
-
Tratamiento de inmunodeficiencias primarias
-
Vacunas (I): Bases inmunológicas
Funciones efectoras del complemento
Aquí tienes el temario explicado en el vídeo anterior. Si tienes alguna duda plantéala en el sistema de comentarios del final de la página.
Mecanismos efectores del sistema de complemento
Tras la activación del sistema de complemento por cualquiera de las vías posibles, los elementos de este sistema interactúan en una cascada minuciosamente regulada para llevar a cabo cuatro funciones básicas (Figura 12.1):
- Lisis de bacterias Gram-negativas, parásitos, virus con envoltura y células del huésped.
- Opsonización de antígenos particulados, que permite su fagocitosis.
- Activación de la respuesta inflamatoria, gracias a los receptores del complemento y a la secreción de moléculas inmunorreguladoras.
- Aclaramiento de inmunocomplejos o inmunodepuración, que elimina complejos antí- geno-anticuerpo de la circulación a través del bazo y el hígado.
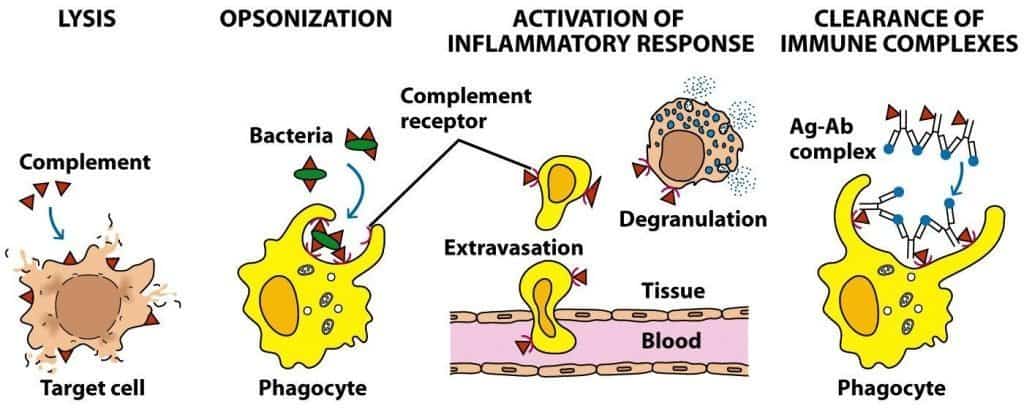
(Reproducido de Kindt T.J., Goldsby R.A., Osborne B.A. & Palacios R. (2007) Inmunología de Kuby (6ª Ed.) McGraw-Hill Interamericana, Madrid.)
Lisis de bacterias Gram-negativas, parásitos, virus con envoltura, eritrocitos y células nucleadas
La formación del complejo de ataque a la membrana (MAC) permite lesionar la pared de bacterias Gram-negativas, parásitos, virus con envoltura y células del huésped (eritrocitos y células nucleadas) mediante la formación de un poro en su bicapa lipídica. Aunque este mecanismo efector del complemento puede parecer muy destructivo, en realidad su papel en la defensa del huésped está limitado a unos pocos patógenos, siendo mucho más importantes los mecanismos de opsonización y activación de la respuesta inflamatoria.
La formación del MAC es el mayor elemento defensivo del complemento frente a las bacterias Gram-negativas, especialmente las del género Neisseria. Estas bacterias se asocian a la gonorrea, una enfermedad de transmisión sexual, y a algunas formas de meningitis bacteriana, una infección grave del sistema nervioso central. La formación del MAC lesiona los elementos estructurales de la bacteria, provocando un shock osmótico que da lugar a su lisis. No obstante, algunos grupos de bacterias Gram-negativas han desarrollado mecanismos de escape a la acción del MAC. Así por ejemplo, algunas cepas de Escherichia coli o Salmonella han desarrollado cadenas laterales en el lipopolisacárido de la pared celular que impiden la inserción del MAC en la pared bacteriana. Los pacientes con deficiencias de los componentes C5-C9 del complemento son más susceptibles a las enfermedades antes mencionadas. Con carácter general, las bacterias Gram-positivas son resistentes a la acción del MAC, gracias a su capa gruesa de peptidoglicano y a la cápsula bacteriana.
La capa más externa de los viriones o partículas víricas puede ser una cápside o una envoltura. Los virus con envoltura son más lábiles ante factores ambientales, como el ácido, los detergen- tes, la desecación o el calor; mientras que los virus sin envoltura, al contrario de lo que podría parecer, son resistentes a todos esos factores. La mayoría de los virus con envoltura son susceptibles a la lisis mediada por el complemento. La envoltura vírica deriva en su mayoría de la membrana plasmática de las células del hospedador infectado y, por tanto, es posible la formación de poros mediada por el MAC. El complemento y los anticuerpos tienen un papel clave en la defensa contra los virus y son cruciales para contener la diseminación vírica durante la infección aguda y para proteger contra una nueva infección. Entre los virus susceptibles de lisis mediada por el complemento se encuentran las familias Herpesviridae (VHS-1, VHS-2, VVZ, VEB, CMV,…), Ortomixoviridae (virus de la gripe A, B y C), Paramixoviridae (virus del sarampión, virus de la parotiditis, virus sincitial respiratorio,…) y Retroviridae (VIH, HTLV,…).
Las células del huésped también pueden ser lisadas por acción del MAC, como ocurre con los eritrocitos, que tienen una capacidad limitada para resistir y reparar las lesiones en su membrana, en procesos como la anemia hemolítica autoinmune y otros trastornos hemolíticos. Las células nucleadas, por su parte, pueden escapar a la acción lítica del MAC con mayor facilidad. No obstante, la formación de poros en la membrana permite la entrada de iones de Ca2+ al interior de la célula, activando numerosos mecanismos que pueden contribuir a la aparición de enfermedades. El mecanismo por el que las células nucleadas escapan a la acción del complemento es la endocitosis del MAC, de manera que la célula puede llegar a reparar el daño en la membrana y restablecer su equilibrio osmótico. Una consecuencia desafortunada de este hecho es que la lisis mediada por complemento desencadenada por anticuerpos específicos frente a antígenos de células tumorales, que constituye una posible cura para el cáncer, es ineficaz por la endocitosis del MAC por parte de estas células.
Opsonización
La activación del sistema de complemento y sus correspondientes mecanismos de amplificación da lugar al recubrimiento de la superficie de los elementos diana, como las bacterias y los inmunocomplejos, por las opsoninas (fragmentos mayores) resultantes de la proteólisis de las moléculas inactivas.
El principal factor responsable de la opsonización mediada por el complemento es C3b, aunque también tienen esta función iC3b y C4b. Las células fagocíticas expresan receptores del complemento (CR1, CR3 y CR4) capaces de unirse a las opsoninas. La unión entre las opsoninas y sus receptores permite la fagocitosis del elemento opsonizado, que puede encontrarse en estado completo o en estado particulado tras su lisis, iniciándose el procesamiento del antígeno y acelerando la síntesis de anticuerpos específicos (Figura 12.2).

(Reproducido de Kindt T.J., Goldsby R.A., Osborne B.A. & Palacios R. (2007) Inmunología de Kuby (6ª Ed.) McGraw-Hill Interamericana, Madrid.)
Activación de la respuesta inflamatoria
Durante el proceso de formación del MAC se generan unos péptidos pequeños que resultan de la escisión de las proteínas del complemento inactivas. Estos fragmentos, llamados anafilotoxinas (C3a, C4a y C5a), se unen a receptores en los mastocitos y basófilos, induciendo su degranulación, con la consiguiente liberación de histamina, TNF-α y otros mediadores inflamatorios responsables del inicio de la respuesta inflamatoria (Figura 12.3).
Además, las anafilotoxinas inducen la contracción del músculo liso y aumentan la permeabilidad vascular, permitiendo la entrada del plasma cargado de anticuerpos y de células fagocíticas al lugar donde se encuentra el antígeno.
C3a y C5a son capaces de inducir la adhesión al endotelio de los monocitos y neutrófilos, permitiendo su extravasación y migración hacia el sitio de activación del complemento en un tejido. La anafilotoxina C5a es el mediador más potente de estos procesos, y es eficaz en con- centraciones picomolares. Además, C5a es capaz de inducir la expresión del receptor CR1 en las células fagocíticas, facilitando la fagocitosis de antígenos recubiertos con C3b.
Las anafilotoxinas son sustancias muy reactivas, y están reguladas por una proteasa sérica de- nominada carboxipeptidasa-N, que escinde un residuo de arginina del extremo carboxilo- terminal de las moléculas y produce las correspondiente formas desarginadas. La forma des-Arg de C3a es completamente inactiva, mientras que la forma des-Arg de C5a mantiene cierta acti- vidad quimiotáctica y capacidad de contraer el músculo liso.

(Reproducido de Male D., Brostoff J., Roth D.B. & Roit I. (2013) Immunology (8th Ed.) Elsevier Saunders, Filadelfia.)
Cuando las anafilotoxinas se producen en grandes cantidades o se inyectan sistémicamente, inducen un colapso circulatorio generalizado, que produce un síndrome parecido al shock mediado por anticuerpos de tipo IgE. Esta reacción se denomina shock anafiláctico, y es una reacción alérgica muy grave que puede producir la muerte por asfixia en pocos minutos (Figura 12.4). El tratamiento debe iniciarse de inmediato siempre que se sospeche, inyectando 0.3-0.5 mg de adrenalina intramuscular (en adultos), repetible cada 5-10 minutos, y un antihistamínico como la dexclorfeniramina (Polaramine®). Además, se deben proporcionar medidas adecuadas de soporte ventilatorio y hemodinámico.
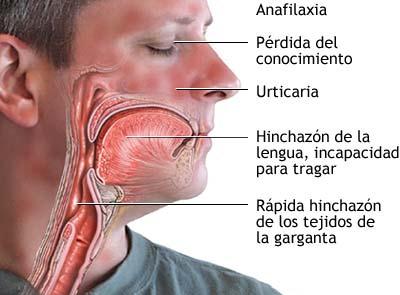
(Reproducido de ADAM.)
Aclaramiento de inmunocomplejos
Los inmunocomplejos son complejos formados por anticuerpos y restos de patógenos o células del huésped muertas. Debido a su enorme tendencia a la agregación e integración de más componentes, los inmunocomplejos pueden depositarse en los lechos capilares, la piel, el riñón y otros órganos, produciendo enfermedades. Este hecho ocurre en enfermedades como el lupus eritematoso sistémico.
La activación de la vía clásica del complemento opsoniza de forma eficiente los inmunocomplejos y previene su precipitación en los tejidos. Para ello, C3b recubre los antígenos en el núcleo del inmunocomplejo, evitando su crecimiento. Además, C3b disgrega los inmunocomplejos grandes impidiendo la interacción antígeno-anticuerpo. Por último, el C3b y C4b que recubre la superficie de los inmunocomplejos interacciona con los receptores CR1 de los eritrocitos, a los cuales se unen. La adhesión a los eritrocitos permite transportar los inmunocomplejos peligrosos hasta los macrófagos del bazo y el hígado, donde son internalizados y destruidos.
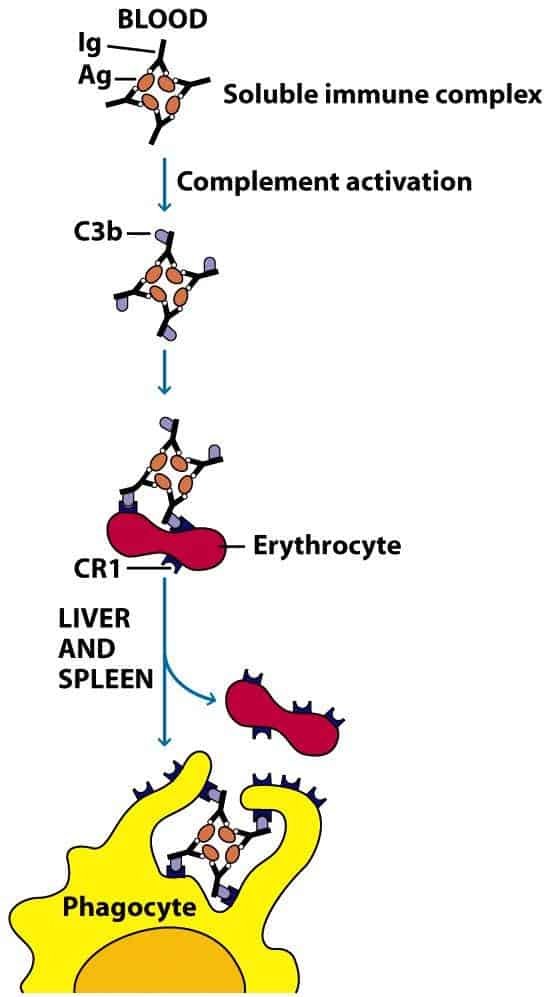
(Reproducido de Kindt T.J., Goldsby R.A., Osborne B.A. & Palacios R. (2007) Inmunología de Kuby (6ª Ed.) McGraw-Hill Interamericana, Madrid.)

Responses