Inmunología Humana
-
INTRODUCCIÓN AL SISTEMA INMUNE HUMANOIntroducción. Conceptos básicos10 Temas
-
Introducción Inmunología
-
Funciones sistema inmune y barreras de defensa
-
Inmunidad innata vs adaptativa
-
Respuesta humoral vs celular
-
Respuesta adaptativa primaria vs secundaria
-
Características de la respuesta inmunitaria adaptativa
-
Concepto de antígeno
-
La respuesta inmunitaria específica es clonal
-
Revisión de los componentes del sistema inmunitario
-
Patología general del sistema inmunitario
-
Introducción Inmunología
-
Células del sistema inmune y diferenciación celular6 Temas
-
Hematopoyesis
-
Las células sanguíneas (I): Granulocitos y Mastocitos
-
Las células sanguíneas (II): Plaquetas, Eritrocitos, Monocitos y Macrófagos
-
Las células sanguíneas (III): Linfocitos (T y B), Células plasmáticas y LGL (Linfocitos NK)
-
Las células sanguíneas (IV): Células dendríticas y proporciones relativas de los tipos celulares
-
Funciones y gestión de receptores para antígenos
-
Hematopoyesis
-
Tejidos del sistema inmune: órganos linfoides 1º y 2º3 Temas
-
Células y mecanismos de la inmunidad innata (I): macrófagos, receptores y mecanismos efectores5 Temas
-
Células y mecanismos de la inmunidad innata (II): linfocitos NK, receptores y mecanismos efectores4 Temas
-
MOLÉCULAS IMPLICADAS EN EL RECONOCIMIENTO DE ANTÍGENOEl receptor de antígeno del linfocito B6 Temas
-
Inmunoglobulinas (I): Formas en la naturaleza, estructura y dominio básico
-
Inmunoglobulinas (II): Clases, formas, variabilidad y tejidos
-
Inmunoglobulinas (III): Enlaces antígeno-anticuerpo y funciones
-
Inmunoglobulinas (IV): Receptores para inmunoglobulinas
-
Inmunoglobulinas (V): Procesamiento de RNA, receptor del linfocito B, complejo co-receptor y activación célula B
-
Inmunoglobulinas (VI): Desarrollo / Diferenciación células B
-
Inmunoglobulinas (I): Formas en la naturaleza, estructura y dominio básico
-
El receptor de antígeno del linfocito T4 Temas
-
Mecanismos de generación de la diversidad de linfocitos T y B9 Temas
-
Genes para las cadenas pesadas y ligeras: Diversidad potencial
-
Reordenamiento de los genes
-
Mecanismos de amplificación de la diversidad
-
Expresión de las inmunoglobulinas en el BCR
-
Maduración de los linfocitos B
-
La cooperación T-B
-
Anomalías/Problemas en el proceso (CLÍNICA)
-
Maduración de los linfocitos B
-
Variabilidad en el repertorio del TcR en linfocitos T
-
Genes para las cadenas pesadas y ligeras: Diversidad potencial
-
El complejo principal de histocompatibilidad (I): estructura proteica, genética y nomenclatura3 Temas
-
El complejo principal de histocompatibilidad (II): Procesamiento y presentación de antígeno, polimorfismo y aplicaciones clínicas5 Temas
-
MOLÉCULAS ACCESORIAS DE LA RESPUESTA INMUNEEl sistema del complemento y sus receptores (I): vía clásica y vía alternativa4 Temas
-
El sistema del complemento y sus receptores (II): vía de las lectinas, vía lítica y regulación3 Temas
-
Moléculas implicadas en la comunicación intercelular (I): citocinas y sus receptores5 Temas
-
Moléculas implicadas en la comunicación intercelular (II): moléculas de adhesión y sus ligandos3 Temas
-
EL SISTEMA INMUNE EN ACCIÓN BLOQUEGeneración de linfocitos T efectores4 Temas
-
Generación de linfocitos B efectores7 Temas
-
Sistema Inmune asociado a mucosas (MALT)9 Temas
-
Introducción MALT
-
Estructura del tejido linfoide asociado a la mucosa intestinal
-
Recirculación y migración selectiva de linfocitos al intestino
-
Barrera epitelial intestinal: Función Inmunológica
-
Receptores para el reconocimiento de patrones moleculares
-
Inmunoglobulinas Poliméricas: IgM + IgA
-
Vías de entrada del antígeno en el intestino
-
Diferenciación de los linfocitos T efectores MALT
-
Tolerancia Oral ante antígenos solubles
-
Introducción MALT
-
La respuesta inmune (I): inmunidad innata e inflamación aguda8 Temas
-
Barreras no específicas frente a infección por microorganismos patógenos
-
Principales leucocitos que paticipan en las inmunidad innata
-
La rección inflamatoria
-
Inflamación aguda
-
Sucesos del proceso inflamatorio
-
Citocinas producidas por macrófagos: efectos locales y sistémicos
-
Efectos de las citocinas en la inmunidad innata
-
Proteínas de fase aguda
-
Barreras no específicas frente a infección por microorganismos patógenos
-
La respuesta inmune (II): mecanismos de la inmunidad específica8 Temas
-
La respuesta inmune (III): respuesta frente a virus, bacterias y hongos, protozoos y helmintos9 Temas
-
Principales enfermedades infecciosas mortales
-
Patógenos infecciosos
-
Respuestas frente a bacterias extracelulares
-
Respuesta frente a bacterias intracelulares
-
Proceso de fagocitosis
-
Respuestas frente a protozoos y helmintos
-
Ciclo vital del plasmodium
-
Respuestas inmunitarias frente a virus
-
Mecanismos de evasión inmunitaria. Virales y bacterianos.
-
Principales enfermedades infecciosas mortales
-
REGULACIÓN e INTRODUCCIÓN A LA INMUNOPATOLOGÍARegulación de la respuesta inmune (I): regulación por moléculas8 Temas
-
Regulación de la respuesta inmune: Introducción
-
Regulación por moléculas: el complemento (I)
-
Proteínas reguladoras del complemento y proceso de regulación (II)
-
Proceso de regulación por complemento (III)
-
Regulación de los anticuerpos preformados
-
Regulación por anticuerpos: Redes idiotípicas
-
Regulación por moléculas de linfocitos T
-
Regulación a nivel bioquímico: ITAM frente a ITIM
-
Regulación de la respuesta inmune: Introducción
-
Regulación de la respuesta inmune (II): regulación por células y sistemas4 Temas
-
El sistema inmune a lo largo del ciclo vital: Inmunosenescencia6 Temas
-
Introducción a la inmunopatología13 Temas
-
Conceptos básicos
-
Inmunodeficiencias
-
Las Inmunodeficiencias (II): Déficits de Complemento
-
Las Inmunodeficiencias (III): Déficits de citocinas en receptores
-
Las Inmunodeficiencias (IV): Déficits de TLR's
-
Las Inmunodeficiencias (V): Déficits de función fagocitaria
-
Las Inmunodeficiencias (VI): Déficit de linfocitos B
-
Las Inmunodeficiencias (VII): Déficits de linfocitos T
-
Inmunodeficiencias primarias (IDP's): Clínica y Diagnóstico
-
Hipersensibilidades
-
Autoinmunidad
-
Trasplantes. Rechazo
-
Inmunidad frente a tumores
-
Conceptos básicos
-
Introducción a la Inmunoterapia8 Temas
-
Vacunas (I): Bases inmunológicas
-
Vacunas (II): Tipos de vacunas
-
Inmunoterapia frente a enfermedades autoinmunes
-
Anticuerpos monoclonales en la terapia del cáncer
-
Otras estrategias anti-tumorales
-
Tratamiento “clásico” de la patología alérgica
-
Inmunoterapia en el trasplante de órganos
-
Tratamiento de inmunodeficiencias primarias
-
Vacunas (I): Bases inmunológicas
SuperAntígenos, Péptidos presentados (Clase I y Clase II)
Aquí tienes el temario explicado en el vídeo anterior. Si tienes alguna duda plantéala en el sistema de comentarios del final de la página.
Preferencias en la unión de péptidos a moléculas MHC
Moléculas MHC de clase I
Las moléculas MHC de clase I poseen una cavidad de unión de péptidos formada por un suelo de láminas β antiparalelas sobre el que descansan dos hélices α (Figura 10.4-AB). Dado que esta cavidad está formada por los dominios α1 y α2 de la cadena α de MHC de clase I, es decir, por una única proteína, es un sitio muy rígido para la unión de los péptidos.
Además de esta limitación, es necesario que los péptidos cumplan otras características para poder unirse a MHC de clase I:
- Longitud: la longitud de los péptidos que se unen a MHC de clase I oscila entre 8 y 11 aminoácidos, siendo preferentes los de 9 aminoácidos.
- Extremos: los péptidos se unen a las moléculas MHC de clase I a través de sus extre- mos amino y carboxilo terminales.
- Residuos críticos de anclaje: en las moléculas MHC de clase I existen subolsillos que determinan qué tipo de aminoácidos se pueden unir a ellas (aromáticos, hidrofóbicos, apolares,…). De esta forma, las moléculas MHC de clase I determinan los péptidos que se pueden unir (Figura 10.4-CD, Figura 10.5, Figura 10.6-CDE).
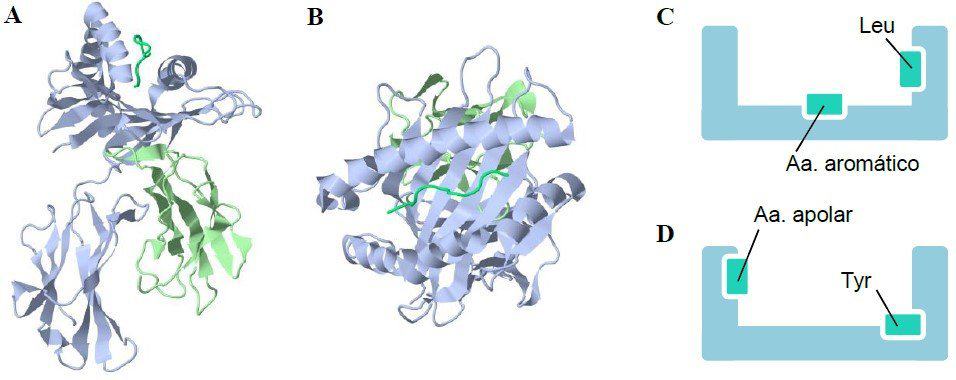
(A) (B) Diagrama en cintas de MHC de clase I, vista lateralmente (A) y superiormente (B). En ambos casos, se observa un péptido antigénico en la cavidad de unión de péptidos. (C) (D) Esque- ma de la cavidad de unión de péptidos de las moléculas MHC de clase I en la que se representan los residuos críticos de anclaje de los péptidos antigénicos. (C) representa la molécula de la figura 10.5-A. (D) representa la molécula de la figura 10.5-B. (Cortesía de David Pérez Torres, Universidad de Valladolid.)
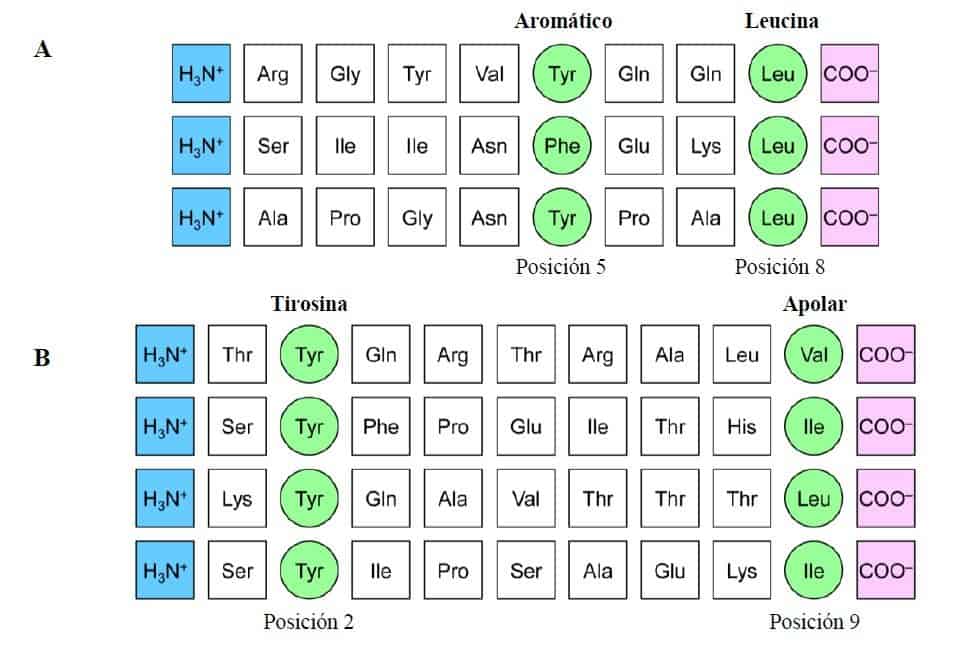
La figura representa las secuencias de aminoácidos de péptidos extraídos de dos moléculas MHC de clase I distintas. Los residuos de anclaje (representados en color verde) son distintos para los péptidos que se unen a los diferentes alelos de las moléculas MHC de clase I, pero son similares para todos los péptidos que se anclan a la misma molécula. Los péptidos también se unen a los extremos amino-terminal (representado en color azul) y carboxilo-terminal (representado en rosa) de las moléculas MHC de clase I. (A) Los péptidos que se unen a esta molécula MHC de clase I lo hacen mediante residuos de anclaje que no tienen por qué ser idénticos, pero están relacionados: en la posición 5 son siempre aromáticos y en la posición 8 es siempre leucina. (B) En esta otra molé- cula MHC de clase I, el péptido unido debe contener tirosina en la posición 2 y un aminoácido
apolar en la posición 9. (Redibujado y modificado de Murphy K et al. (2008) Janeway’s Immuno- biology (7th Ed.) Garland Science, Nueva York.)
Moléculas MHC de clase II
La cavidad de unión de péptidos de las moléculas MHC de clase II está compuesta por dos moléculas distintas unidas no covalentemente, las cadenas α y β, lo que le convierte en una cavi- dad más flexible que la de las moléculas MHC de clase I (Figura 10.6-AB). Este hecho permite que los péptidos que se unen sean de hasta más de 20 aminoácidos, por lo que frecuentemente cuelgan a ambos lados de la cavidad. Normalmente el péptido se une a MHC de clase II por 9 residuos de aminoácidos. Al igual que en MHC de clase I, existen residuos críticos de anclaje (Figura 10.6-CD
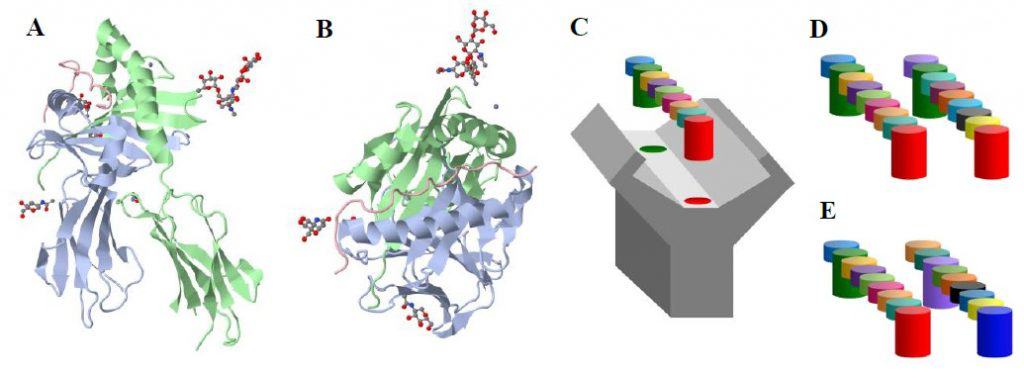
(A) (B) Diagrama en cintas de MHC de clase II, vista lateralmente (A) y superiormente (B). En ambos casos, se observa un péptido antigénico en la cavidad de unión de péptidos y la posición de anclaje de otras moléculas. (C) Representación esquemática de la unión de un nonapéptido a una molécula MHC de clase I ó II. Nótese que los residuos críticos de anclaje (representados en verde y en rojo) son diferentes en cada molécula MHC. (D) Representación esquemática de un péptido con los mismos residuos de anclaje que el de la Figura 10.6-C. (E) Representación esquemática de un péptido con diferentes residuos de anclaje que el de la Figura 10.6-C, por lo que no se puede
unir a la molécula MHC de dicha figura. (Cortesía de David Pérez Torres, Universidad de Valladolid.)
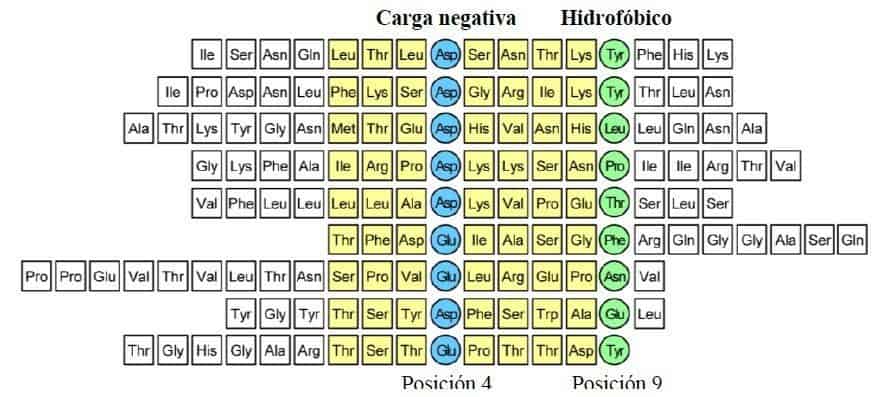
Secuencia de péptidos que se unen al alelo HLA-DR3 de MHC de clase II humano. La longitud de los péptidos es variable y, por convenio, el primer residuo de anclaje se denota con el número 1. La zona de contacto entre el péptido y MHC de clase II comprende 9 aminoácidos. Todos los péptidos comparten un aminoácido con carga negativa en la posición 4 (ácido aspártico o ácido glutámico) (representado en color azul) y tienden a presentar un residuo hidrofóbico en la posición 9 (repre- sentado en color verde). (Redibujado y modificado de Murphy K et al. (2008) Janeway’s Immuno-
biology (7th Ed.) Garland Science, Nueva York.)
Superantígenos
Los antígenos convencionales son procesados por células presentadoras de antígenos y son presentados a los linfocitos T en moléculas MHC de clase II (Figura 10.8-A). En este caso, se activan los linfocitos TH con receptores que sean capaces de reconocer el antígeno y comienzan a producir citocinas. Los linfocitos TH activados estimulan únicamente a los linfocitos B que reaccionan con el antígeno contra el que se está generando la respuesta, de forma que el sistema inmunitario sólo genera anticuerpos contra el antígeno que le fue presentado en la molécula MHC de clase II.
Los superantígenos (SAg), como la enterotoxina B del Staphylococcus (SEB), que produce intoxicación alimentaria en humanos, no pueden ser procesados por las células presentadoras de antígenos. En su lugar, se unen directamente zonas constantes de las moléculas MHC de clase II de las células presentadoras de antígenos y a zonas constantes del TcR de los linfocitos TH, formando un puente entre ambas estructuras molecular.
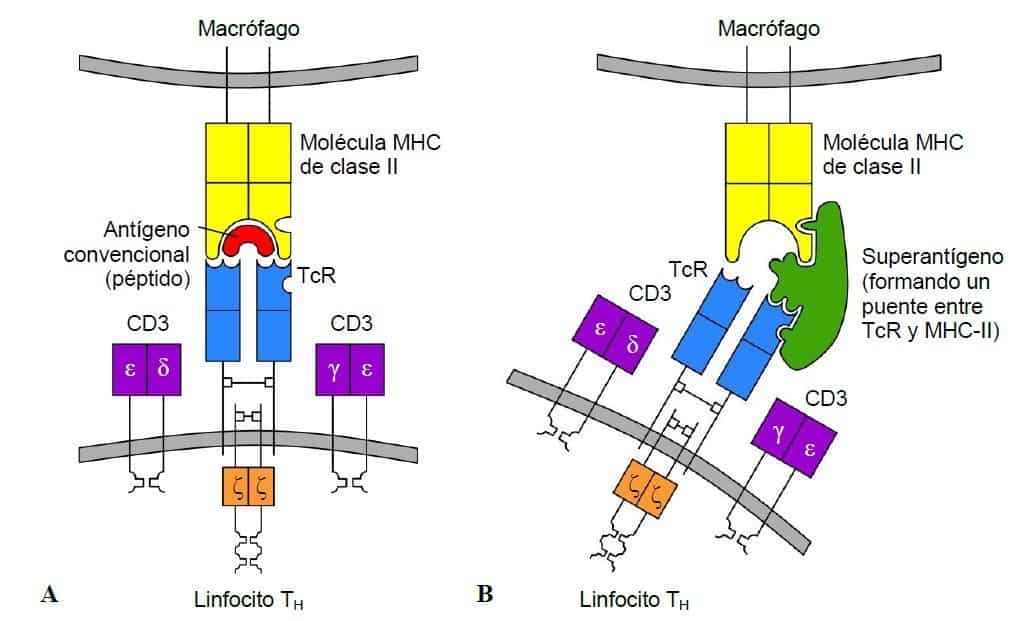
(A) Los antígenos convencionales son presentados a los linfocitos T en moléculas MHC de clase
II. El reconocimiento entre MHC, el péptido y el TcR activa la cantidad necesaria de linfocitos TH específicos para el antígeno. (B) Los superantígenos son capaces de formar puentes entre las re- giones constantes de las moléculas MHC de clase II y TcR. No se produce un reconocimiento específico entre el superantígeno, MHC y TcR, lo que activa una cantidad excesiva de linfocitos TH, que desembocará en una respuesta peligrosa para el individuo. (Redibujado y modificado de Regueiro JR et al. (2003) Inmunología. Biología y Patología del Sistema Inmune. (3ª Ed.) Editorial Médica Panamericana, Madrid.)
Los antígenos convencionales presentados en moléculas MHC de clase II se unen únicamente a los linfocitos TH que los reconocen de forma específica, que representan un porcentaje mucho menor del 0.01% del repertorio linfocitario T total del individuo. En cambio, los superantígenos son capaces de unirse de forma inespecífica a multitud de moléculas MHC de clase II y TcR, lo que produce la activación de una cantidad excesiva de linfocitos TH que, en este caso, representa entre el 2% y el 25% del repertorio linfocitario T total del individuo
La activación de los linfocitos TH da lugar a la producción de citocinas, entre las que cabe des- tacar la interleucina 2 (IL-2). En el caso de los antígenos convencionales, la producción de citocinas es un acontecimiento que ocurre a nivel local y permite la eliminación del antígeno de forma adecuada. En el caso de los superantígenos, la sobreproducción de citocinas por el excesivo número de linfocitos TH activados no se puede contener a nivel local y alcanza el torrente circulatorio (Figura 10.9). La entrada de citocinas en la circulación produce efectos adversos en el individuo como fiebre, náuseas, vómitos y diarrea. En los casos más graves puede producirse shock, fallo multiorgánico, fallo circulatorio e, incluso, la muerte.
La habilidad de los SAgs de linfocitos T para unirse a grandes cantidades de moléculas MHC de clase II de forma inespecífica les permite desencadenar procesos peligrosos para la vida del individuo, lo que les convierte en un grupo de moléculas completamente indeseable.
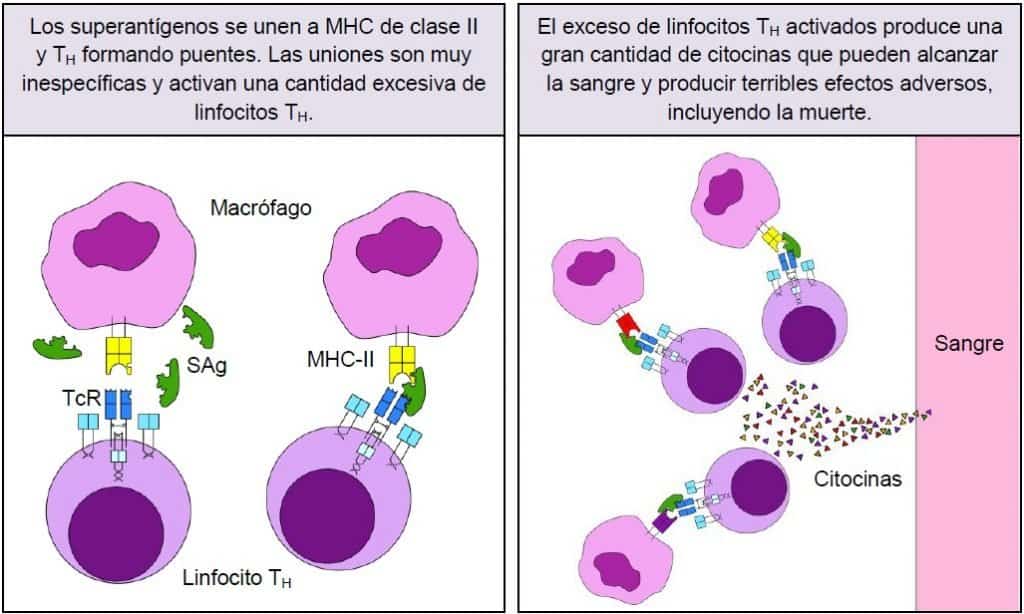
Los superantígenos se unen a MHC de clase II y a TcR formando un puente entre ambas estructu- ras. La inespecificidad de la unión permite a los superantígenos activar hasta un 25% de los linfo- citos TH del individuo. La gran cantidad de citocinas producida por los linfocitos TH activados no puede ser contenida a nivel local y entra al torrente circulatorio, produciendo efectos no deseables.
(Cortesía de David Pérez Torres, Universidad de Valladolid.)
Recientemente se ha descrito una nueva clase de superantígenos, que activa de forma específica a los linfocitos B e induce su apoptosis, por lo que se les conoce como superantígenos de lin- focitos B. Los superantígenos de linfocitos B se unen a las regiones FAB de las inmunoglobulinas fuera de sus regiones determinantes de complementariedad. La proteína A del Staphylococcus (SpA), el SAg mejor estudiado de esta clase, recciona con las regiones FAB de la mayoría de las inmunoglobulinas VH3+, que se expresan en el 30-60% de los linfocitos B periféricos huma- nos. Otros SAgs de linfocito B son gp120 del virus de inmunodeficiencia humana (HIV), la proteína Fv (una sialoproteína hepática humana) o la enterotoxina D del Staphylococcus (SED).
La habilidad de los SAgs de linfocitos B para unirse a
grandes cantidades de inmunoglobulina sérica les confiere unas propiedades
biológicas potencialmente peligrosas.
Presentación de antígenos no proteicos: sistema CD1
Existen numerosos mecanismos que confieren al sistema inmune la capacidad de generar una gran variedad de linfocitos T, lo que permite reconocer una amplia variedad de antígenos y organizar una respuesta adaptativa adecuada frente a patógenos de características muy distintas. La mayor parte del repertorio linfocitario T reconoce péptidos antigénicos presentados por las moléculas altamente polimórficas del MHC. Sin embargo, existe una población significativa de células T que no reaccionan ante los antígenos presentados por MHC. En su lugar, este conjunto de células T se une a las moléculas de una familia presentadora de antígenos llamada CD1.
Las moléculas CD1 son glicoproteínas de tipo MHC de clase I, o MHC class I-like, que se es- pecializan en la unión de lípidos y glicolípidos para su posterior presentación a las células T. Existen cinco genes CD1 situados en el cromosoma 1, denominados CD1A, CD1B, CD1C, CD1D y CD1E. A pesar del limitado polimorfismo alélico que presenta el sistema CD1, estas moléculas son capaces de unir y presentar un amplio rango de estructuras lipídicas procedentes de patógenos e, incluso, de tejidos ajenos trasplantados.
CD1 (Figura 10.10) es la primera glicoproteína que expresan los timocitos en la diferenciación tímica. Estructuralmente es un heterodímero formado por una cadena α, que contiene tres do- minios (α1, α2 y α3), a la que se asocia de forma no covalente una proteína soluble denominada β2-microglobulina. Entre los dominios α1 y α2 se forma una cavidad física que permite la unión de lípidos denominada cavidad de unión antigénica (por analogía con la cavidad de unión de péptidos del sistema MHC)
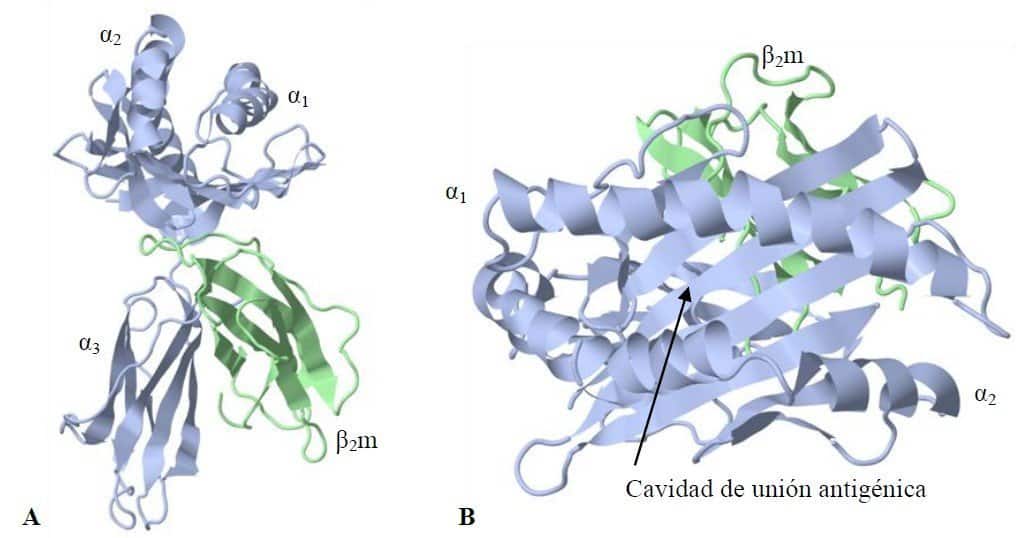
CD1 representa un tercer linaje de moléculas presentadoras de antígenos pero, a diferencia de las moléculas MHC, el tipo de antígeno presentado es de carácter lipídico. La estructura cristalina de CD1d1 del ratón, correspondiente a la CD1d humana, adopta una conformación muy similar a la de MHC de clase I. (A) Nótense las similitudes estructurales entre MHC de clase I y CD1. CD1 está formada por una cadena α de tres dominios y una molécula asociada de β2-microglobulina. Al igual que en las moléculas MHC de clase I, los dominios α1 y α2 constituyen el lugar de unión para los antígenos. (B) Se muestra la cavidad de unión antigénica de CD1, significativamente más
estrecha que la cavidad de unión de péptidos de las moléculas MHC pero mucho más profunda que ésta y con dos bolsillos de carácter hidrofóbico. (RCSB PDB ID 1CD1)
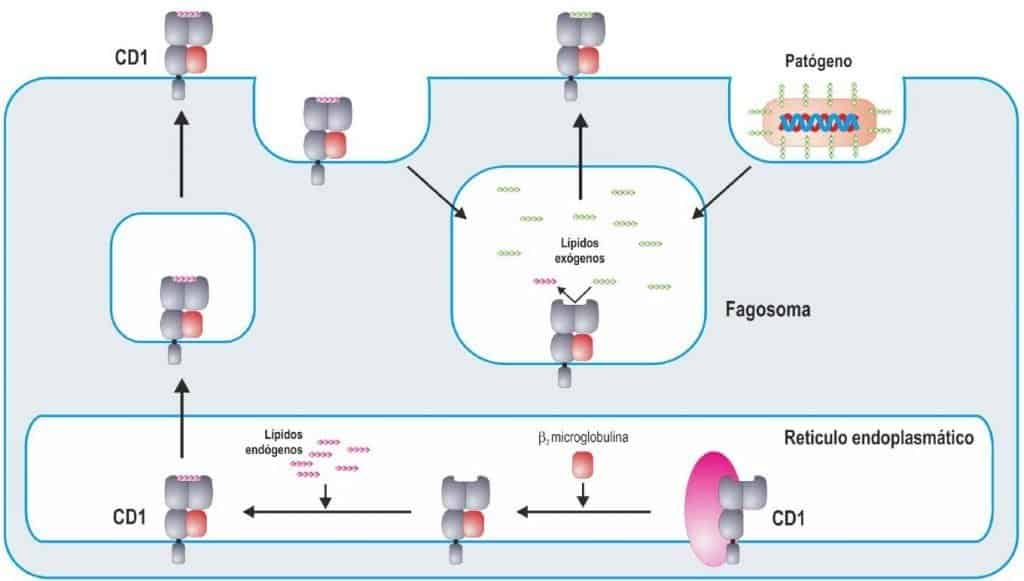
Las moléculas CD1 se sintetizan en el retículo endoplasmático rugoso y, después, sufren un proceso de maduración similar al de las moléculas MHC de clase I (Figura 10.11). Las cadenas α son glicosiladas por glicosidasas del retículo endoplasmático y su plegamiento está mediado por chaperonas como la calnexina, la calcirreticulina y ERp57. La asociación posterior de la β2– microglobulina estabiliza el complejo y, en la mayoría de las moléculas de la familia, es un requerimiento imprescindible para que CD1 se exprese en la superficie celular.
(A) Los antígenos convencionales son presentados a los linfocitos T en moléculas MHC de clase
II. El reconocimiento entre MHC, el péptido y el TcR activa la cantidad necesaria de linfocitos TH específicos para el antígeno. (B) Los superantígenos son capaces de formar puentes entre las re- giones constantes de las moléculas MHC de clase II y TcR. No se produce un reconocimiento específico entre el superantígeno, MHC y TcR, lo que activa una cantidad excesiva de linfocitos TH, que desembocará en una respuesta peligrosa para el individuo. (Reproducido de Regueiro J.R.,
López C., González S. & Martínez E. (2011) Inmunología. Biología y Patología del Sistema Inmu- ne. (4ª Ed.) Editorial Médica Panamericana, Madrid.)
Las moléculas CD1 se expresan únicamente en células presentadoras de antígeno profesionales, especialmente en células dendríticas y macrófagos. Las moléculas CD1 presentan los antígenos glicolipídicos a los linfocitos T, pero no a los convencionales, sino a los doble negativos (CD4– CD8–). CD1d, que se expresa además en el epitelio intestinal, presenta sus antígenos a un tipo especial de linfocito denominado NKT, que presentan los marcadores característicos de los linfocitos NK, pero son un tipo especializado de linfocitos T, con función citotóxica y capacidad de sintetizar citocinas.
Se cree que el sistema CD1 es complementario al sistema HLA; mientras que las moléculas HLA presentan una muestra de los péptidos del interior celular, las moléculas CD1 presentarán lípidos. De esta manera una célula sana sólo presentará lípidos propios, pero una célula infecta- da puede presentar lípidos microbianos que entonces pueden ser reconocidos por los linfocitos
T. La diversidad lipídica de los seres vivos es mucho menor que la de proteínas o péptidos, por esta razón las moléculas CD1 no son polimórficas, ya que están diseñadas para alojar un número limitado y bien definido de lípidos.

Responses