Inmunología Humana
-
INTRODUCCIÓN AL SISTEMA INMUNE HUMANOIntroducción. Conceptos básicos10 Temas
-
Introducción Inmunología
-
Funciones sistema inmune y barreras de defensa
-
Inmunidad innata vs adaptativa
-
Respuesta humoral vs celular
-
Respuesta adaptativa primaria vs secundaria
-
Características de la respuesta inmunitaria adaptativa
-
Concepto de antígeno
-
La respuesta inmunitaria específica es clonal
-
Revisión de los componentes del sistema inmunitario
-
Patología general del sistema inmunitario
-
Introducción Inmunología
-
Células del sistema inmune y diferenciación celular6 Temas
-
Hematopoyesis
-
Las células sanguíneas (I): Granulocitos y Mastocitos
-
Las células sanguíneas (II): Plaquetas, Eritrocitos, Monocitos y Macrófagos
-
Las células sanguíneas (III): Linfocitos (T y B), Células plasmáticas y LGL (Linfocitos NK)
-
Las células sanguíneas (IV): Células dendríticas y proporciones relativas de los tipos celulares
-
Funciones y gestión de receptores para antígenos
-
Hematopoyesis
-
Tejidos del sistema inmune: órganos linfoides 1º y 2º3 Temas
-
Células y mecanismos de la inmunidad innata (I): macrófagos, receptores y mecanismos efectores5 Temas
-
Células y mecanismos de la inmunidad innata (II): linfocitos NK, receptores y mecanismos efectores4 Temas
-
MOLÉCULAS IMPLICADAS EN EL RECONOCIMIENTO DE ANTÍGENOEl receptor de antígeno del linfocito B6 Temas
-
Inmunoglobulinas (I): Formas en la naturaleza, estructura y dominio básico
-
Inmunoglobulinas (II): Clases, formas, variabilidad y tejidos
-
Inmunoglobulinas (III): Enlaces antígeno-anticuerpo y funciones
-
Inmunoglobulinas (IV): Receptores para inmunoglobulinas
-
Inmunoglobulinas (V): Procesamiento de RNA, receptor del linfocito B, complejo co-receptor y activación célula B
-
Inmunoglobulinas (VI): Desarrollo / Diferenciación células B
-
Inmunoglobulinas (I): Formas en la naturaleza, estructura y dominio básico
-
El receptor de antígeno del linfocito T4 Temas
-
Mecanismos de generación de la diversidad de linfocitos T y B9 Temas
-
Genes para las cadenas pesadas y ligeras: Diversidad potencial
-
Reordenamiento de los genes
-
Mecanismos de amplificación de la diversidad
-
Expresión de las inmunoglobulinas en el BCR
-
Maduración de los linfocitos B
-
La cooperación T-B
-
Anomalías/Problemas en el proceso (CLÍNICA)
-
Maduración de los linfocitos B
-
Variabilidad en el repertorio del TcR en linfocitos T
-
Genes para las cadenas pesadas y ligeras: Diversidad potencial
-
El complejo principal de histocompatibilidad (I): estructura proteica, genética y nomenclatura3 Temas
-
El complejo principal de histocompatibilidad (II): Procesamiento y presentación de antígeno, polimorfismo y aplicaciones clínicas5 Temas
-
MOLÉCULAS ACCESORIAS DE LA RESPUESTA INMUNEEl sistema del complemento y sus receptores (I): vía clásica y vía alternativa4 Temas
-
El sistema del complemento y sus receptores (II): vía de las lectinas, vía lítica y regulación3 Temas
-
Moléculas implicadas en la comunicación intercelular (I): citocinas y sus receptores5 Temas
-
Moléculas implicadas en la comunicación intercelular (II): moléculas de adhesión y sus ligandos3 Temas
-
EL SISTEMA INMUNE EN ACCIÓN BLOQUEGeneración de linfocitos T efectores4 Temas
-
Generación de linfocitos B efectores7 Temas
-
Sistema Inmune asociado a mucosas (MALT)9 Temas
-
Introducción MALT
-
Estructura del tejido linfoide asociado a la mucosa intestinal
-
Recirculación y migración selectiva de linfocitos al intestino
-
Barrera epitelial intestinal: Función Inmunológica
-
Receptores para el reconocimiento de patrones moleculares
-
Inmunoglobulinas Poliméricas: IgM + IgA
-
Vías de entrada del antígeno en el intestino
-
Diferenciación de los linfocitos T efectores MALT
-
Tolerancia Oral ante antígenos solubles
-
Introducción MALT
-
La respuesta inmune (I): inmunidad innata e inflamación aguda8 Temas
-
Barreras no específicas frente a infección por microorganismos patógenos
-
Principales leucocitos que paticipan en las inmunidad innata
-
La rección inflamatoria
-
Inflamación aguda
-
Sucesos del proceso inflamatorio
-
Citocinas producidas por macrófagos: efectos locales y sistémicos
-
Efectos de las citocinas en la inmunidad innata
-
Proteínas de fase aguda
-
Barreras no específicas frente a infección por microorganismos patógenos
-
La respuesta inmune (II): mecanismos de la inmunidad específica8 Temas
-
La respuesta inmune (III): respuesta frente a virus, bacterias y hongos, protozoos y helmintos9 Temas
-
Principales enfermedades infecciosas mortales
-
Patógenos infecciosos
-
Respuestas frente a bacterias extracelulares
-
Respuesta frente a bacterias intracelulares
-
Proceso de fagocitosis
-
Respuestas frente a protozoos y helmintos
-
Ciclo vital del plasmodium
-
Respuestas inmunitarias frente a virus
-
Mecanismos de evasión inmunitaria. Virales y bacterianos.
-
Principales enfermedades infecciosas mortales
-
REGULACIÓN e INTRODUCCIÓN A LA INMUNOPATOLOGÍARegulación de la respuesta inmune (I): regulación por moléculas8 Temas
-
Regulación de la respuesta inmune: Introducción
-
Regulación por moléculas: el complemento (I)
-
Proteínas reguladoras del complemento y proceso de regulación (II)
-
Proceso de regulación por complemento (III)
-
Regulación de los anticuerpos preformados
-
Regulación por anticuerpos: Redes idiotípicas
-
Regulación por moléculas de linfocitos T
-
Regulación a nivel bioquímico: ITAM frente a ITIM
-
Regulación de la respuesta inmune: Introducción
-
Regulación de la respuesta inmune (II): regulación por células y sistemas4 Temas
-
El sistema inmune a lo largo del ciclo vital: Inmunosenescencia6 Temas
-
Introducción a la inmunopatología13 Temas
-
Conceptos básicos
-
Inmunodeficiencias
-
Las Inmunodeficiencias (II): Déficits de Complemento
-
Las Inmunodeficiencias (III): Déficits de citocinas en receptores
-
Las Inmunodeficiencias (IV): Déficits de TLR's
-
Las Inmunodeficiencias (V): Déficits de función fagocitaria
-
Las Inmunodeficiencias (VI): Déficit de linfocitos B
-
Las Inmunodeficiencias (VII): Déficits de linfocitos T
-
Inmunodeficiencias primarias (IDP's): Clínica y Diagnóstico
-
Hipersensibilidades
-
Autoinmunidad
-
Trasplantes. Rechazo
-
Inmunidad frente a tumores
-
Conceptos básicos
-
Introducción a la Inmunoterapia8 Temas
-
Vacunas (I): Bases inmunológicas
-
Vacunas (II): Tipos de vacunas
-
Inmunoterapia frente a enfermedades autoinmunes
-
Anticuerpos monoclonales en la terapia del cáncer
-
Otras estrategias anti-tumorales
-
Tratamiento “clásico” de la patología alérgica
-
Inmunoterapia en el trasplante de órganos
-
Tratamiento de inmunodeficiencias primarias
-
Vacunas (I): Bases inmunológicas
Inmunoglobulinas (II): Clases, formas, variabilidad y tejidos
Aquí tienes el temario explicado en el vídeo anterior. Si tienes alguna duda plantéala en el sistema de comentarios del final de la página.
Isotipos de inmunoglobulinas
Pequeñas variaciones en la secuencia de aminoácidos de las regiones constantes de las cadenas ligeras y pesadas (que afectan al tamaño, carga y solubilidad de la proteína) definen diferentes subtipos de las cadenas (isotipos):
- Se conocen 5 tipos de cadenas pesadas: μ, δ, γ, α y ε. Son estructural y funcionalmente diferentes entre sí.
- Además hay 2 tipos de cadenas ligeras: κ y λ. Son estructural y funcionalmente equivalentes.
Las Igs toman su nombre de la cadena pesada, independientemente del tipo de cadena ligera que lleven. Así hay: IgM, IgD, IgG, IgA e IgE, respectivamente (Figura 6.5).
Pero además, pequeñas variaciones dentro de las moléculas de los isotipos IgG e IgA permiten diferenciar cuatro subclases de IgG (IgG1, IgG2, IgG3 e IgG4; con cadenas pesadas γ1, γ2, γ3 y γ4, respectivamente) y dos subclases de IgA (IgA1 e IgA2; cadenas α1 y α2). Por lo tanto, en conjunto hay nueve isotipos de Igs que pueden contener cadenas ligeras κ ó λ.
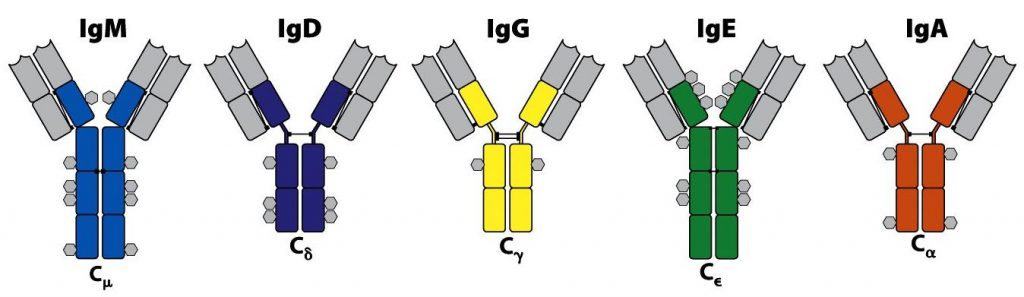

(Reproducido de Murphy K., Travers P. & Walport M. (2008) Janeway’s Immunobiology (7th Ed.) Garland Science, Nueva York.)
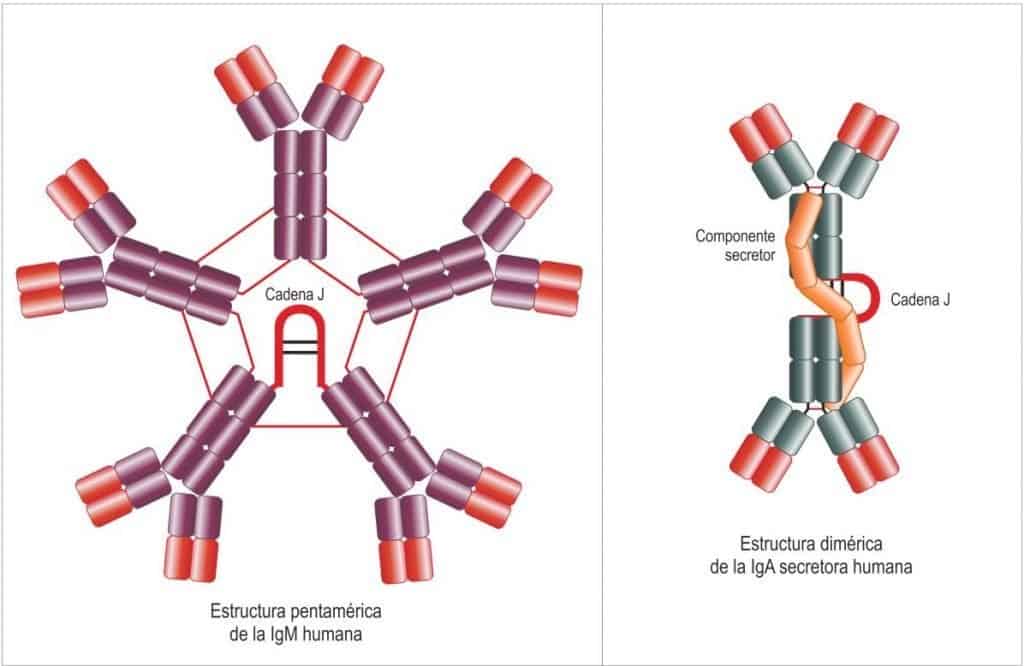
(Reproducido de Regueiro J.R., López C., González S. & Martínez E. (2011) Inmunología. Biología y Patología del Sistema Inmune. (4ª Ed.) Editorial Médica Panamericana, Madrid.)
Diferencias entre las clases de Igs (Figura 6.5):
- Las moléculas IgE y IgM tienen una región bisagra muy disminuida y tienen un cuarto dominio constante (CH4).
- Cada Ig tiene, además, puntos de glicosilación que se representan mediante hexágonos. IgA e IgD son las que están más glicosiladas; tienen glicosilación intermedia IgE e IgM, y la menos glicosilada es la IgG (Figura 6.5).
- Dos clases pueden aparecer en forma multimérica (Figura 6.6), formando estructuras adicionales. Así, la IgM (en suero) se presenta habitualmente en pentámeros (5 unidades estructurales básicas), que en conjunto suman 10 cadenas pesadas y 10 ligeras. Las cin- co Igs están unidas por sus Fc con una cadena J (join=unión), dejando libres las zonas de unión con el antígeno. En total puede reconocer diez Ags idénticos independientes. La IgA se presenta habitualmente en dímeros unidos por una cadena J diferente a la de IgM. Además la IgA puede aparecer con otro péptido asociado (componente secretor, que le da resistencia a la acidez) para formar la IgA secretora (sIg) que tiene un papel importante en las mucosas. En total reconoce cuatro Ags idénticos independientes en la superficie de los patógenos.
Además las Ig pueden presentar diferentes alotipos (variaciones menores polimórficas o alélicas en las secuencias aminoacídicas en las regiones constantes de las cadenas pesadas y ligeras que se segregan de acuerdo con la genética mendeliana).
Variabilidad de las inmunoglobulinas
Los dominios variables son los que reconocen específicamente el antígeno. En cada dominio variable la proteína se pliega dejando tres puntos de contacto con el antígeno. Estos puntos se denominan regiones hipervariables (HV) o también CDR (regiones determinantes de la com- plementariedad con el antígeno). Las regiones, menos variables, que flanquean a las anteriores se denominan regiones flanqueantes (FR) (Figura 6.7).
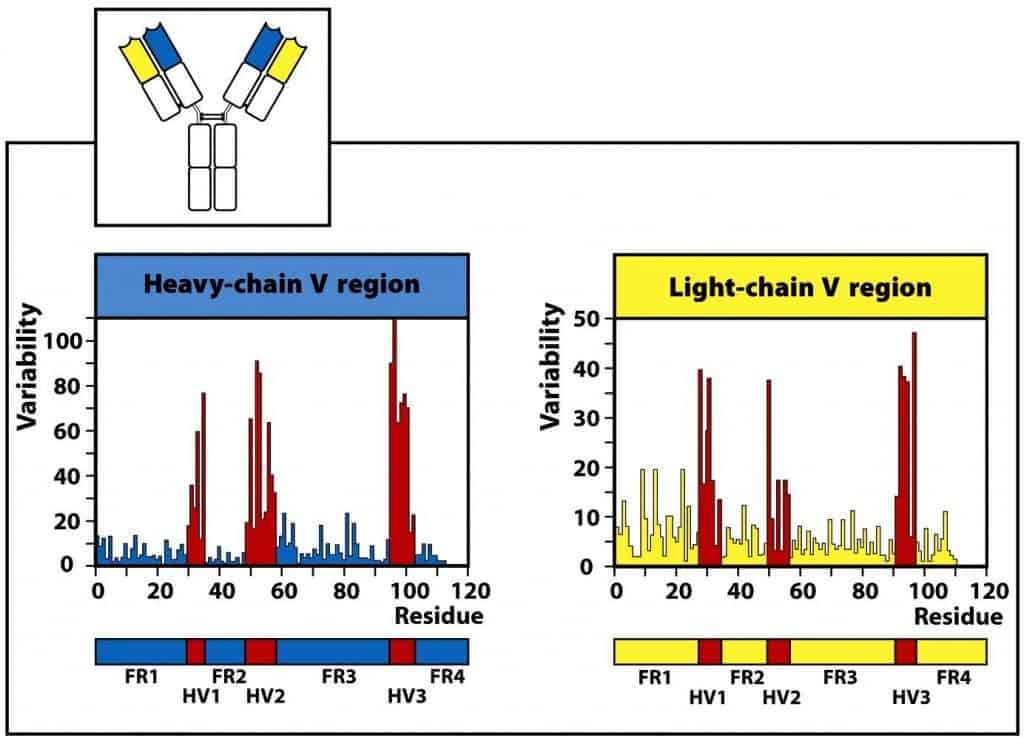
(Reproducido de Murphy K., Travers P. & Walport M. (2008) Janeway’s Immunobiology (7th Ed.) Garland Science, Nueva York.)
Algunos de los aminoácidos de las regiones hipervariables CDR1, CDR2 Y CDR3 pueden presentar un 100% de variabilidad de Ig a Ig. La zona de contacto íntimo con el antígeno (conjunción de las porciones CDR de cadenas pesadas y ligeras) se denomina parátopo, que aparea con el epítopo de un determinado antígeno. Cada uno de estos segmentos CDR tiene una longitud de 5-10 aa. La extrema variabilidad encontrada en las regiones V de las inmunoglobulinas es un reflejo de la necesidad de reconocer un gran número de estructuras antigénicas. La mayoría de los puntos de contacto corresponde a la tercera región hipervariable (CDR3), donde se acumula la mayor variabilidad.
Organización genética de las inmunoglobulinas
Cada cadena de la Ig (pesada o ligera) está codificada por un conjunto de genes. El dominio variable está codificado por genes V, D y J (en las pesadas) o solo V y J (en las ligeras). Los dominios constantes están codificados por un único gen (C). Hay un gen C para cada uno de los isotipos de cadena pesada (Figura 6.8), cada uno de los cuales se denota con una “C” seguida del equivalente en griego de la clase:
- IgM – Cμ, existe sólo 1 gen para esta cadena.
- IgD – Cδ, existe 1 gen para esta cadena.
- IgG – Cγ, existen 4 genes: γ1, γ2, γ3 y γ4.
- IgE – Cε, existe 1 gen para esta cadena.
- IgA – Cα, existen 2 genes: α1 y α2.
Las células B en reposo transcriben RNA que incluye los 2 primeros genes constantes (Cμ y Cδ). Por procesamiento alternativo de RNA, las células pueden simultáneamente procesar RNAs para IgM e IgD, ambas con la misma especificidad de antígeno, puesto que contienen el mismo reordenamiento VDJ.
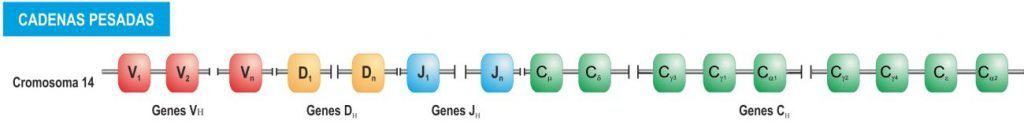
(Reproducido de Regueiro J.R., López C., González S. & Martínez E. (2011) Inmunología. Biología y Patología del Sistema Inmune. (4ª Ed.) Editorial Médica Panamericana, Madrid.)

Responses