Inmunología Humana
-
INTRODUCCIÓN AL SISTEMA INMUNE HUMANOIntroducción. Conceptos básicos10 Temas
-
Introducción Inmunología
-
Funciones sistema inmune y barreras de defensa
-
Inmunidad innata vs adaptativa
-
Respuesta humoral vs celular
-
Respuesta adaptativa primaria vs secundaria
-
Características de la respuesta inmunitaria adaptativa
-
Concepto de antígeno
-
La respuesta inmunitaria específica es clonal
-
Revisión de los componentes del sistema inmunitario
-
Patología general del sistema inmunitario
-
Introducción Inmunología
-
Células del sistema inmune y diferenciación celular6 Temas
-
Hematopoyesis
-
Las células sanguíneas (I): Granulocitos y Mastocitos
-
Las células sanguíneas (II): Plaquetas, Eritrocitos, Monocitos y Macrófagos
-
Las células sanguíneas (III): Linfocitos (T y B), Células plasmáticas y LGL (Linfocitos NK)
-
Las células sanguíneas (IV): Células dendríticas y proporciones relativas de los tipos celulares
-
Funciones y gestión de receptores para antígenos
-
Hematopoyesis
-
Tejidos del sistema inmune: órganos linfoides 1º y 2º3 Temas
-
Células y mecanismos de la inmunidad innata (I): macrófagos, receptores y mecanismos efectores5 Temas
-
Células y mecanismos de la inmunidad innata (II): linfocitos NK, receptores y mecanismos efectores4 Temas
-
MOLÉCULAS IMPLICADAS EN EL RECONOCIMIENTO DE ANTÍGENOEl receptor de antígeno del linfocito B6 Temas
-
Inmunoglobulinas (I): Formas en la naturaleza, estructura y dominio básico
-
Inmunoglobulinas (II): Clases, formas, variabilidad y tejidos
-
Inmunoglobulinas (III): Enlaces antígeno-anticuerpo y funciones
-
Inmunoglobulinas (IV): Receptores para inmunoglobulinas
-
Inmunoglobulinas (V): Procesamiento de RNA, receptor del linfocito B, complejo co-receptor y activación célula B
-
Inmunoglobulinas (VI): Desarrollo / Diferenciación células B
-
Inmunoglobulinas (I): Formas en la naturaleza, estructura y dominio básico
-
El receptor de antígeno del linfocito T4 Temas
-
Mecanismos de generación de la diversidad de linfocitos T y B9 Temas
-
Genes para las cadenas pesadas y ligeras: Diversidad potencial
-
Reordenamiento de los genes
-
Mecanismos de amplificación de la diversidad
-
Expresión de las inmunoglobulinas en el BCR
-
Maduración de los linfocitos B
-
La cooperación T-B
-
Anomalías/Problemas en el proceso (CLÍNICA)
-
Maduración de los linfocitos B
-
Variabilidad en el repertorio del TcR en linfocitos T
-
Genes para las cadenas pesadas y ligeras: Diversidad potencial
-
El complejo principal de histocompatibilidad (I): estructura proteica, genética y nomenclatura3 Temas
-
El complejo principal de histocompatibilidad (II): Procesamiento y presentación de antígeno, polimorfismo y aplicaciones clínicas5 Temas
-
MOLÉCULAS ACCESORIAS DE LA RESPUESTA INMUNEEl sistema del complemento y sus receptores (I): vía clásica y vía alternativa4 Temas
-
El sistema del complemento y sus receptores (II): vía de las lectinas, vía lítica y regulación3 Temas
-
Moléculas implicadas en la comunicación intercelular (I): citocinas y sus receptores5 Temas
-
Moléculas implicadas en la comunicación intercelular (II): moléculas de adhesión y sus ligandos3 Temas
-
EL SISTEMA INMUNE EN ACCIÓN BLOQUEGeneración de linfocitos T efectores4 Temas
-
Generación de linfocitos B efectores7 Temas
-
Sistema Inmune asociado a mucosas (MALT)9 Temas
-
Introducción MALT
-
Estructura del tejido linfoide asociado a la mucosa intestinal
-
Recirculación y migración selectiva de linfocitos al intestino
-
Barrera epitelial intestinal: Función Inmunológica
-
Receptores para el reconocimiento de patrones moleculares
-
Inmunoglobulinas Poliméricas: IgM + IgA
-
Vías de entrada del antígeno en el intestino
-
Diferenciación de los linfocitos T efectores MALT
-
Tolerancia Oral ante antígenos solubles
-
Introducción MALT
-
La respuesta inmune (I): inmunidad innata e inflamación aguda8 Temas
-
Barreras no específicas frente a infección por microorganismos patógenos
-
Principales leucocitos que paticipan en las inmunidad innata
-
La rección inflamatoria
-
Inflamación aguda
-
Sucesos del proceso inflamatorio
-
Citocinas producidas por macrófagos: efectos locales y sistémicos
-
Efectos de las citocinas en la inmunidad innata
-
Proteínas de fase aguda
-
Barreras no específicas frente a infección por microorganismos patógenos
-
La respuesta inmune (II): mecanismos de la inmunidad específica8 Temas
-
La respuesta inmune (III): respuesta frente a virus, bacterias y hongos, protozoos y helmintos9 Temas
-
Principales enfermedades infecciosas mortales
-
Patógenos infecciosos
-
Respuestas frente a bacterias extracelulares
-
Respuesta frente a bacterias intracelulares
-
Proceso de fagocitosis
-
Respuestas frente a protozoos y helmintos
-
Ciclo vital del plasmodium
-
Respuestas inmunitarias frente a virus
-
Mecanismos de evasión inmunitaria. Virales y bacterianos.
-
Principales enfermedades infecciosas mortales
-
REGULACIÓN e INTRODUCCIÓN A LA INMUNOPATOLOGÍARegulación de la respuesta inmune (I): regulación por moléculas8 Temas
-
Regulación de la respuesta inmune: Introducción
-
Regulación por moléculas: el complemento (I)
-
Proteínas reguladoras del complemento y proceso de regulación (II)
-
Proceso de regulación por complemento (III)
-
Regulación de los anticuerpos preformados
-
Regulación por anticuerpos: Redes idiotípicas
-
Regulación por moléculas de linfocitos T
-
Regulación a nivel bioquímico: ITAM frente a ITIM
-
Regulación de la respuesta inmune: Introducción
-
Regulación de la respuesta inmune (II): regulación por células y sistemas4 Temas
-
El sistema inmune a lo largo del ciclo vital: Inmunosenescencia6 Temas
-
Introducción a la inmunopatología13 Temas
-
Conceptos básicos
-
Inmunodeficiencias
-
Las Inmunodeficiencias (II): Déficits de Complemento
-
Las Inmunodeficiencias (III): Déficits de citocinas en receptores
-
Las Inmunodeficiencias (IV): Déficits de TLR's
-
Las Inmunodeficiencias (V): Déficits de función fagocitaria
-
Las Inmunodeficiencias (VI): Déficit de linfocitos B
-
Las Inmunodeficiencias (VII): Déficits de linfocitos T
-
Inmunodeficiencias primarias (IDP's): Clínica y Diagnóstico
-
Hipersensibilidades
-
Autoinmunidad
-
Trasplantes. Rechazo
-
Inmunidad frente a tumores
-
Conceptos básicos
-
Introducción a la Inmunoterapia8 Temas
-
Vacunas (I): Bases inmunológicas
-
Vacunas (II): Tipos de vacunas
-
Inmunoterapia frente a enfermedades autoinmunes
-
Anticuerpos monoclonales en la terapia del cáncer
-
Otras estrategias anti-tumorales
-
Tratamiento “clásico” de la patología alérgica
-
Inmunoterapia en el trasplante de órganos
-
Tratamiento de inmunodeficiencias primarias
-
Vacunas (I): Bases inmunológicas
Aplicaciones de polimorfismos HLA
Aquí tienes el temario explicado en el vídeo anterior. Si tienes alguna duda plantéala en el sistema de comentarios del final de la página.
Aplicaciones clínicas del conocimiento del polimorfismo HLA
Estudios de asociación entre el HLA y las enfermedades
Ciertas enfermedades humanas ocurren con mayor frecuencia en individuos portadores de determinados alelos de los genes HLA. Entre estas enfermedades se incluyen la susceptibilidad a agentes infecciosos, un gran número de trastornos mediados por el sistema inmunológico, como las enfermedades autoinmunes, y algunas otras situaciones clínicas. La asociación entre el HLA y las enfermedades no monogénicas utiliza el elevado polimorfismo del sistema HLA para apo- yar el diagnóstico de ciertas enfermedades, si bien debe tenerse en cuenta que no son una prueba que permita confirmar el diagnóstico de forma aislada. La asociación estadística no es absoluta, lo cual es indicador de que algunos otros genes, así como factores ambientales, desempeñan su papel en el mecanismo fisiopatogénico de las mismas. Por ello, el hecho de expresar ciertos antígenos HLA confiere cierta susceptibilidad, pero no puede asegurar la producción de la enfermedad.
El vigor de una asociación HLA se expresa por el riesgo relativo (RR) de desarrollar una enfermedad cuando un antígeno está presente en un individuo frente al riesgo de desarrollarla cuando éste no está presente. Por tanto, el riesgo relativo es la fuerza de asociación de una enfermedad con un determinado antígeno o alelo HLA, y se refiere a la probabilidad de que una persona manifieste una enfermedad particular si está presente un alelo HLA específico. Cuanto mayor sea el RR más significativa es la asociación.
Un aumento estadísticamente significativo de la frecuencia de un antígeno HLA en un grupo de pacientes con una enfermedad concreta, se interpreta generalmente como evidencia de que éste está asociado con una susceptibilidad elevada a dicha enfermedad. Sin embargo el estudio de relaciones HLA y enfermedad presenta varios problemas:
- Los alelos asociados a una enfermedad también se encuentran en la población normal. Por tanto, la presencia de un alelo no significa que vaya a desarrollarse la enfermedad, pudiendo aparecer incluso en personas que carecen de dicho alelo.
- Un solo alelo se puede asociar con más de una enfermedad.
- En una misma enfermedad no hay asociación en el 100% de los casos con un solo alelo.
A continuación, se enumeran brevemente algunas enfermedades autoinmunes y su relación con el serotipo HLA (Figura 10.13):
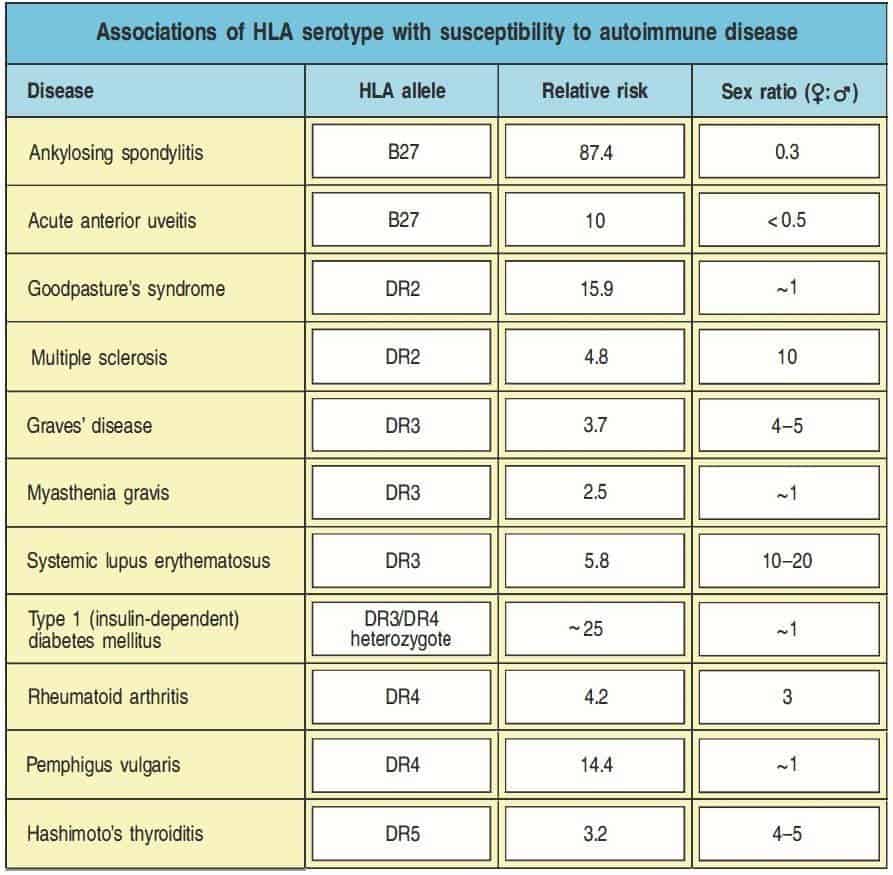
(Reproducido de Murphy K et al. (2012) Janeway’s Immunobiology (8th Ed.) Garland Science, Nueva York.)
- Espondilitis anquilosante (EA): es una enfermedad inflamatoria crónica del raquis, perteneciente al grupo de las espondiloartropatías seronegativas, que cursa con afectación de las articulaciones sacroilíacas y, con menor frecuencia, a las articulaciones periféricas, y que evoluciona hacia la anquilosis (fusión de los elementos articulares con disminución del grado de movimiento). Se desconoce la etiología, aunque se han identificado factores genéticos (HLA-B27, presente en más del 90% de los enfermos) y ambientales (reactividad cruzada con Klebsiella pneumoniae, bacterias entéricas,…). De todos los individuos HLA-B27 positivos, solo un 2% desarrolla una espondilitis anquilosante. La positividad HLA-B27 no es un criterio diagnóstico de espondilitis y es independiente de la gravedad del proceso. La enfermedad es más frecuente en varones, suele aparecer entre los 15 y 30 años, y se manifiesta como dolor lumbar, artritis periférica y osteoporosis. La manifestación extraarticular más frecuente es la uveítis anterior aguda, donde la presencia de HLA-B27 también juega un papel importante.
- Lupus eritematoso sistémico (LES): es una enfermedad inflamatoria multisistémica, de carácter crónico, en la que se produce una lesión tisular por depósito de autoanticuerpos e inmunocomplejos. Se desconoce la etiología, aunque se han implicado facto- res genéticos (HLA-DR3, HLA-DR2 y HLA-B8), étnicos (tres veces más frecuente en raza negra), hormonales (diez veces más frecuente en mujeres en edad fértil), ambientales (luz ultravioleta, virus, fármacos,…) e inmunitarios (alteración de todos los elementos del sistema inmunitario). La enfermedad es más frecuente en mujeres y en raza negra, suele aparecer entre los 20 y 40 años, y puede afectar a cualquier sistema del organismo, siendo más frecuente las alteraciones generales (fiebre, astenia, anorexia, pérdida de peso y malestar general), musculoesqueléticas (artralgias y mialgias), cutáneas (fotosensibilidad) y hematológicas (pancitopenia).
- Diabetes mellitus tipo 1 autoinmune o DM tipo 1A: síndrome caracterizado por la destrucción de las células β pancreáticas por autoanticuerpos, que produce un déficit absoluto de insulina. Se desconoce la etiología, pero se han implicado factores genéticos (HLA-DR3 y HLA-DR4, presentando un RR de 25 los heterocigotos) y ambientales (virus y alimentos). La enfermedad no tiene predilección por ningún sexo, suele aparecer entre la pubertad y los 40 años, y se manifiesta de forma brusca con clínica cardinal de diabetes (poliuria, polidipsia, polifagia y pérdida de peso).
Importancia del sistema HLA en los trasplantes de órganos
El trasplante es un proceso por el que se toman células vivas, tejidos u órganos de un individuo, en conjunto denominados injertos, y se transfieren de una parte del organismo a otra, o de un individuo a otro distinto. La sustitución de un órgano o tejido que ya no funciona tiene el objetivo de restituir las funciones perdidas del receptor y la deficiencia anatómica. En muchos pacientes, el trasplante es la única alternativa que puede salvarle la vida y recuperar la calidad de la misma. El individuo que proporciona el injerto se denomina donante y la que lo recibe receptor o huésped.
En la actualidad se realizan trasplantes de corazón, pulmón, hígado, riñones, intestino, páncreas, huesos, piel, córnea, tendones, válvulas cardiacas, cartílago y vasos sanguíneos (Figura 10.14). Según la nueva posición que adopten las células, tejidos u órganos injertados, se diferencian dos tipos de trasplante: ortotópico y heterotópico. En el trasplante ortotópico el injerto se coloca en su posición anatómica normal. En el trasplante heterotópico el injerto se sitúa en una posición anatómica diferente a la normal.
En función de la relación entre el donante y el receptor, se distinguen los siguientes tipos de trasplantes (Figura 10.15):
- Autoinjerto: consiste en trasplantar un tejido de una parte del cuerpo a otra en un mis- mo individuo. Los autoinjertos son aceptados siempre, puesto que el donante y el receptor son la misma persona. Un ejemplo de autoinjerto es el trasplante de piel.
- Isoinjerto: es un injerto realizado entre dos individuos genéticamente idénticos o individuos singénicos. Un ejemplo de isoinjerto es el trasplante realizado entre gemelos monocigóticos. La especificidad de los antígenos comprometidos en el rechazo de un injerto está sujeta al control genético. Los individuos genéticamente idénticos poseen antígenos del trasplante idénticos, por lo que es posible realizar injertos entre ellos sin inconvenientes.
- Aloinjerto: es un injerto entre individuos de la misma especie, o individuos alogénicos, pero con distinta constitución genética. El aloinjerto más frecuente es la trasfusión de sangre, que constituye el trasplante de células sanguíneas circulantes o de plasma de una persona a otra, y cuyas consecuencias de incompatibilidad son nefastas.
- Xenoinjerto: es un injerto realizado entre individuos pertenecientes a distintas especies o individuos xenogénicos.
La práctica clínica de los trasplantes en humanos consiste en realizar aloinertos, en los que do- nante y receptor son individuos genéticamente distintos en la mayoría de los casos. Precisamente estas diferencias genéticas son las responsables de que el receptor ponga en marcha una res puesta inmunitaria de rechazo dirigida contra las estructuras extrañas presentes en las células del injerto del donante que, en la clínica, se trata de evitar mediante el uso de diversos fármacos inmunosupresores.
El rechazo del órgano injertado se produce por la histoincompatibilidad genética entre el receptor y el donante. La histoincompatibilidad entre dos individuos se debe a dos clases de antígenos, los antígenos mayores de histocompatibilidad, o antígenos leucocitarios humanos (HLA), y los antígenos menores de histocompatibilidad, que incluyen factores como el grupo sanguíneo o las proteínas codificadas por genes del cromosoma Y. Todos estos antígenos son proteínas muy polimórficas y se presentan en heterocigosis con mucha frecuencia en la población. Por ello, es muy difícil encontrar coincidencias en sus locus entre personas que no son familiares consanguíneos.
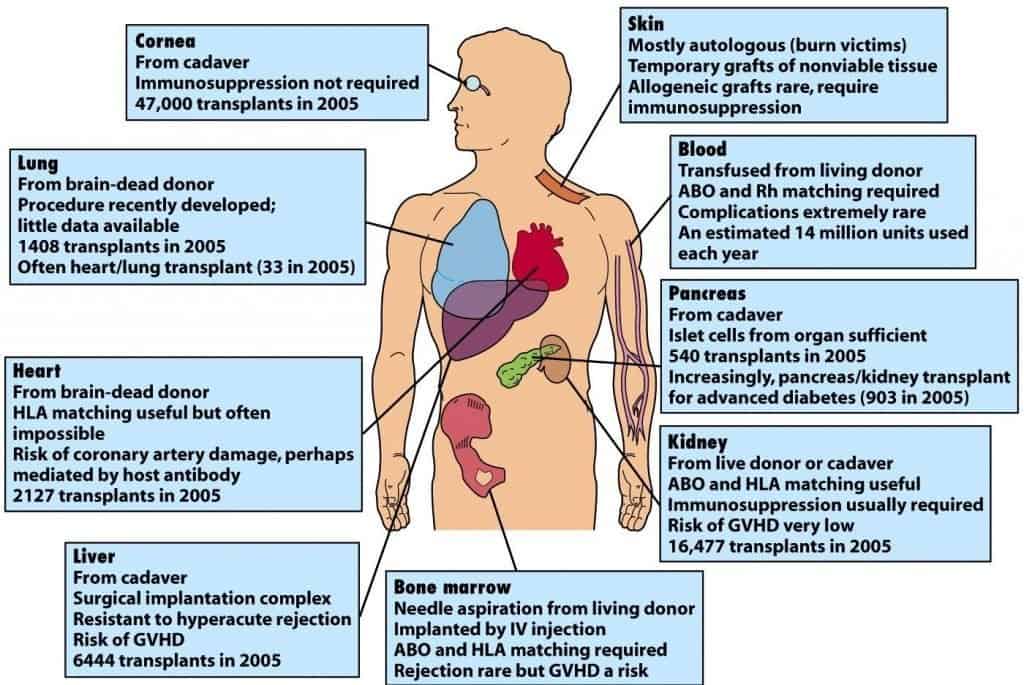
(Reproducido de Kindt T.J. et al. (2007) Inmunología de Kuby (6ª Ed.) McGraw-Hill Interameri- cana, Madrid.)
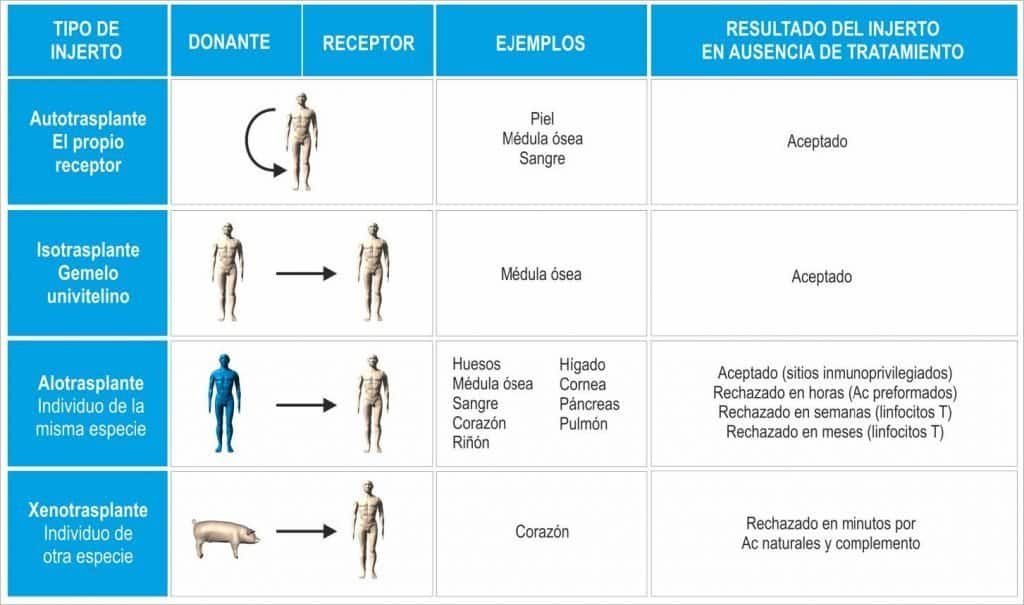
(Reproducido de Regueiro J.R., López C., González S. & Martínez E. (2011) Inmunología. Biolo- gía y Patología del Sistema Inmune. (4ª Ed.) Editorial Médica Panamericana, Madrid.)
La principal causa del rechazo es el elevado polimorfismo de los antígenos leucocitarios humanos (HLA). Los antígenos de histocompatibilidad son clave en el funcionamiento normal del sistema inmune y, con frecuencia, las pequeñas diferencias entre la estructura de los antígenos del donante y del receptor pueden activar una intensa respuesta inmunitaria contra el órgano trasplantado. En diversos estudios se ha demostrado que, en la mayoría de los órganos sólidos (riñón, corazón, pulmón, páncreas,…), cuanto mayor es la histocompatibilidad, es decir, cuan- to menores sean las diferencias entre moléculas HLA del donante y del receptor, mejor es el pronóstico y la evolución del paciente tras el trasplante (Figura 10.16).
Dentro de los antígenos mayores de histocompatibilidad, el elemento más determinante para que se desarrolle el rechazo son las moléculas HLA de clase II. Los antígenos presentados por las moléculas HLA de clase II son reconocidos por linfocitos T CD4+ (cooperadores), mientras que los antígenos presentados por las moléculas HLA de clase I son reconocidos por linfocitos T CD8+ (citotóxicos). La activación de los linfocitos T CD8+ requiere la activación previa de los linfocitos T CD4+, por lo que se puede atribuir una mayor contribución de las moléculas HLA de clase II al desarrollo del rechazo, como se aprecia en la Figura 10.16. Por ello, es fundamental asegurar la coincidencia entre los locus de HLA de clase II del donante y del receptor, de forma que se minimice la intensidad del rechazo.
No obstante, las moléculas HLA de clase I también son
importantes para la supervivencia del injerto y del individuo. En este caso, la
ausencia de moléculas HLA de clase I del receptor en las células del injerto
puede ser reconocida por los receptores inhibidores de la destrucción (KIR) de
los linfocitos NK y producir la muerte de la célula extraña.
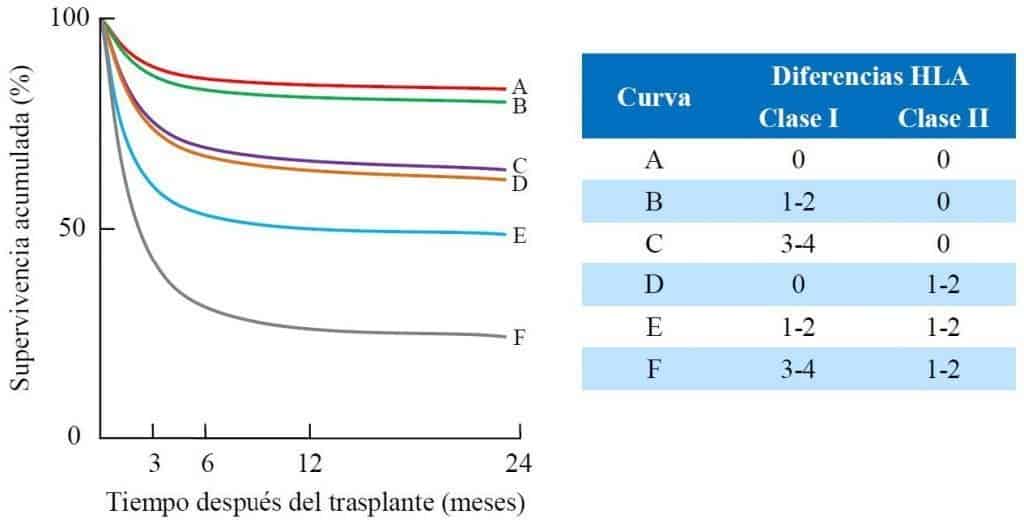
Efecto del número de diferencias en los antígenos HLA de clase I y de clase II entre el donante y el receptor en la supervivencia al trasplante de riñón. La existencia de una o dos diferencias en las moléculas HLA de clase I tiene pocas repercusiones sobre la supervivencia. Una única diferencia entre los antígenos HLA de clase II (curva D) tiene el mismo efecto que 3-4 diferencias entre los antígenos de clase I (curva C). Cuando los antígenos de clase I y de clase II son distintos, el recha- zo al trasplante se produce más rápido. (Reproducido de Pérez Torres D. et al. (2010) Sistema
HLA y su importancia en el trasplante de órganos sólidos. Universidad de Valladolid, Valladolid.)
Utilidad del sistema HLA en medicina legal y forense
Se han utilizado los antígenos HLA en técnicas de medicina legal y forense para identificar individuos, resolver situaciones de paternidad confusa y casos criminales.
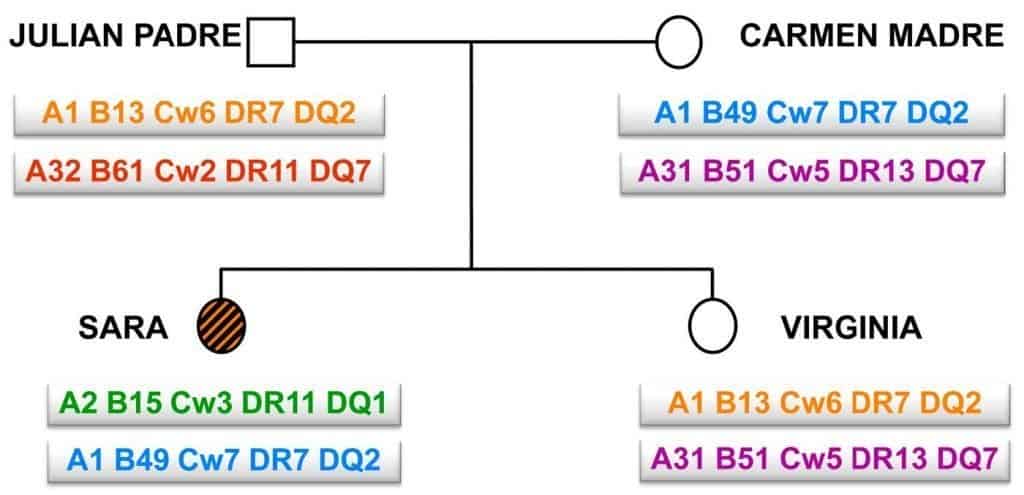
Las pruebas de paternidad basadas en el sistema HLA se fundamentan en el patrón de herencia de los genes del MHC. En este ejemplo, se observa que Sara es hija de Carmen, pero no de Julián.
Virginia, por su parte, es hija de ambos progenitores. (Cortesía de David Pérez Torres y Alfredo Corell Almuzara, Universidad de Valladolid.)

Responses