Inmunología Humana
-
INTRODUCCIÓN AL SISTEMA INMUNE HUMANOIntroducción. Conceptos básicos10 Temas
-
Introducción Inmunología
-
Funciones sistema inmune y barreras de defensa
-
Inmunidad innata vs adaptativa
-
Respuesta humoral vs celular
-
Respuesta adaptativa primaria vs secundaria
-
Características de la respuesta inmunitaria adaptativa
-
Concepto de antígeno
-
La respuesta inmunitaria específica es clonal
-
Revisión de los componentes del sistema inmunitario
-
Patología general del sistema inmunitario
-
Introducción Inmunología
-
Células del sistema inmune y diferenciación celular6 Temas
-
Hematopoyesis
-
Las células sanguíneas (I): Granulocitos y Mastocitos
-
Las células sanguíneas (II): Plaquetas, Eritrocitos, Monocitos y Macrófagos
-
Las células sanguíneas (III): Linfocitos (T y B), Células plasmáticas y LGL (Linfocitos NK)
-
Las células sanguíneas (IV): Células dendríticas y proporciones relativas de los tipos celulares
-
Funciones y gestión de receptores para antígenos
-
Hematopoyesis
-
Tejidos del sistema inmune: órganos linfoides 1º y 2º3 Temas
-
Células y mecanismos de la inmunidad innata (I): macrófagos, receptores y mecanismos efectores5 Temas
-
Células y mecanismos de la inmunidad innata (II): linfocitos NK, receptores y mecanismos efectores4 Temas
-
MOLÉCULAS IMPLICADAS EN EL RECONOCIMIENTO DE ANTÍGENOEl receptor de antígeno del linfocito B6 Temas
-
Inmunoglobulinas (I): Formas en la naturaleza, estructura y dominio básico
-
Inmunoglobulinas (II): Clases, formas, variabilidad y tejidos
-
Inmunoglobulinas (III): Enlaces antígeno-anticuerpo y funciones
-
Inmunoglobulinas (IV): Receptores para inmunoglobulinas
-
Inmunoglobulinas (V): Procesamiento de RNA, receptor del linfocito B, complejo co-receptor y activación célula B
-
Inmunoglobulinas (VI): Desarrollo / Diferenciación células B
-
Inmunoglobulinas (I): Formas en la naturaleza, estructura y dominio básico
-
El receptor de antígeno del linfocito T4 Temas
-
Mecanismos de generación de la diversidad de linfocitos T y B9 Temas
-
Genes para las cadenas pesadas y ligeras: Diversidad potencial
-
Reordenamiento de los genes
-
Mecanismos de amplificación de la diversidad
-
Expresión de las inmunoglobulinas en el BCR
-
Maduración de los linfocitos B
-
La cooperación T-B
-
Anomalías/Problemas en el proceso (CLÍNICA)
-
Maduración de los linfocitos B
-
Variabilidad en el repertorio del TcR en linfocitos T
-
Genes para las cadenas pesadas y ligeras: Diversidad potencial
-
El complejo principal de histocompatibilidad (I): estructura proteica, genética y nomenclatura3 Temas
-
El complejo principal de histocompatibilidad (II): Procesamiento y presentación de antígeno, polimorfismo y aplicaciones clínicas5 Temas
-
MOLÉCULAS ACCESORIAS DE LA RESPUESTA INMUNEEl sistema del complemento y sus receptores (I): vía clásica y vía alternativa4 Temas
-
El sistema del complemento y sus receptores (II): vía de las lectinas, vía lítica y regulación3 Temas
-
Moléculas implicadas en la comunicación intercelular (I): citocinas y sus receptores5 Temas
-
Moléculas implicadas en la comunicación intercelular (II): moléculas de adhesión y sus ligandos3 Temas
-
EL SISTEMA INMUNE EN ACCIÓN BLOQUEGeneración de linfocitos T efectores4 Temas
-
Generación de linfocitos B efectores7 Temas
-
Sistema Inmune asociado a mucosas (MALT)9 Temas
-
Introducción MALT
-
Estructura del tejido linfoide asociado a la mucosa intestinal
-
Recirculación y migración selectiva de linfocitos al intestino
-
Barrera epitelial intestinal: Función Inmunológica
-
Receptores para el reconocimiento de patrones moleculares
-
Inmunoglobulinas Poliméricas: IgM + IgA
-
Vías de entrada del antígeno en el intestino
-
Diferenciación de los linfocitos T efectores MALT
-
Tolerancia Oral ante antígenos solubles
-
Introducción MALT
-
La respuesta inmune (I): inmunidad innata e inflamación aguda8 Temas
-
Barreras no específicas frente a infección por microorganismos patógenos
-
Principales leucocitos que paticipan en las inmunidad innata
-
La rección inflamatoria
-
Inflamación aguda
-
Sucesos del proceso inflamatorio
-
Citocinas producidas por macrófagos: efectos locales y sistémicos
-
Efectos de las citocinas en la inmunidad innata
-
Proteínas de fase aguda
-
Barreras no específicas frente a infección por microorganismos patógenos
-
La respuesta inmune (II): mecanismos de la inmunidad específica8 Temas
-
La respuesta inmune (III): respuesta frente a virus, bacterias y hongos, protozoos y helmintos9 Temas
-
Principales enfermedades infecciosas mortales
-
Patógenos infecciosos
-
Respuestas frente a bacterias extracelulares
-
Respuesta frente a bacterias intracelulares
-
Proceso de fagocitosis
-
Respuestas frente a protozoos y helmintos
-
Ciclo vital del plasmodium
-
Respuestas inmunitarias frente a virus
-
Mecanismos de evasión inmunitaria. Virales y bacterianos.
-
Principales enfermedades infecciosas mortales
-
REGULACIÓN e INTRODUCCIÓN A LA INMUNOPATOLOGÍARegulación de la respuesta inmune (I): regulación por moléculas8 Temas
-
Regulación de la respuesta inmune: Introducción
-
Regulación por moléculas: el complemento (I)
-
Proteínas reguladoras del complemento y proceso de regulación (II)
-
Proceso de regulación por complemento (III)
-
Regulación de los anticuerpos preformados
-
Regulación por anticuerpos: Redes idiotípicas
-
Regulación por moléculas de linfocitos T
-
Regulación a nivel bioquímico: ITAM frente a ITIM
-
Regulación de la respuesta inmune: Introducción
-
Regulación de la respuesta inmune (II): regulación por células y sistemas4 Temas
-
El sistema inmune a lo largo del ciclo vital: Inmunosenescencia6 Temas
-
Introducción a la inmunopatología13 Temas
-
Conceptos básicos
-
Inmunodeficiencias
-
Las Inmunodeficiencias (II): Déficits de Complemento
-
Las Inmunodeficiencias (III): Déficits de citocinas en receptores
-
Las Inmunodeficiencias (IV): Déficits de TLR's
-
Las Inmunodeficiencias (V): Déficits de función fagocitaria
-
Las Inmunodeficiencias (VI): Déficit de linfocitos B
-
Las Inmunodeficiencias (VII): Déficits de linfocitos T
-
Inmunodeficiencias primarias (IDP's): Clínica y Diagnóstico
-
Hipersensibilidades
-
Autoinmunidad
-
Trasplantes. Rechazo
-
Inmunidad frente a tumores
-
Conceptos básicos
-
Introducción a la Inmunoterapia8 Temas
-
Vacunas (I): Bases inmunológicas
-
Vacunas (II): Tipos de vacunas
-
Inmunoterapia frente a enfermedades autoinmunes
-
Anticuerpos monoclonales en la terapia del cáncer
-
Otras estrategias anti-tumorales
-
Tratamiento “clásico” de la patología alérgica
-
Inmunoterapia en el trasplante de órganos
-
Tratamiento de inmunodeficiencias primarias
-
Vacunas (I): Bases inmunológicas
Inmunoglobulinas (I): Formas en la naturaleza, estructura y dominio básico
Aquí tienes el temario explicado en el vídeo anterior. Si tienes alguna duda plantéala en el sistema de comentarios del final de la página.
La respuesta inmunitaria específica se basa en el reconocimiento específico de los antígenos, tanto en la respuesta de linfocitos B, como en la de los T. Para este reconocimiento específico existen unas proteínas fundamentales en cada tipo de linfocito, y las inmunoglobulinas son las moléculas específicas para antígeno propias de las células B. Por ende, la función principal del linfocito es la síntesis de inmunoglobulinas.
Las inmunoglobulinas son un grupo grande de proteínas presentes en el suero y otros fluidos del organismo. Se pueden encontrar en dos formas principales:
- Forma soluble, denominadas entonces anticuerpos.
- Ancladas en la membrana de los linfocitos B, formando parte del receptor para antígeno de las células B (BcR).
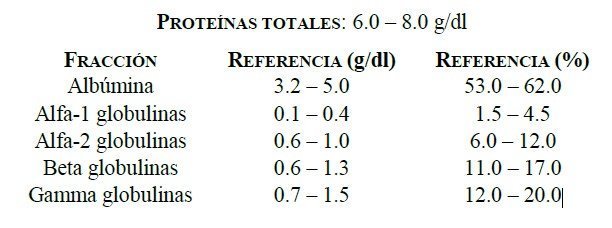
Las inmunoglobulinas se localizan en la fracción gamma de las proteínas del suero tras separar- las por electroforesis en un proteinograma (Figura 6.1).
Las Inmunoglobulinas
Estructura básica proteica
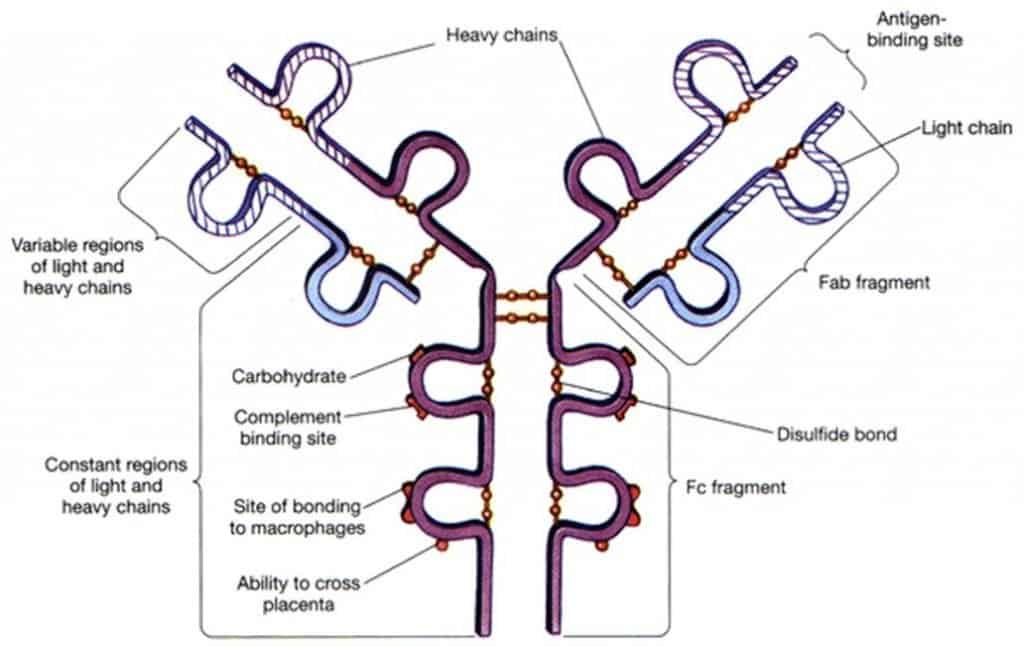
Las inmunoglobulinas tienen una estructura común de 4 cadenas polipeptídicas iguales dos a dos. Esta estructura se integra con dos cadenas pesadas (H=heavy) y dos cadenas ligeras (L=light) idénticas en cada molécula de inmunoglobulina (Figura 6.2). El peso molecular de las cadenas H oscila entre 55-77 KD y el de las cadenas L es de 25 KD. Las distintas cadenas se estabilizan con puentes disulfuro entre las dos cadenas pesadas y entre cada cadena pesada y otra ligera (pero nunca entre dos cadenas ligeras).
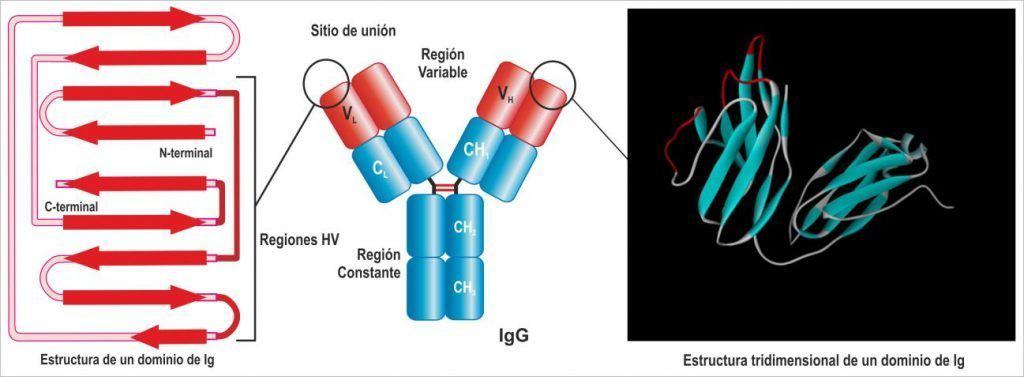
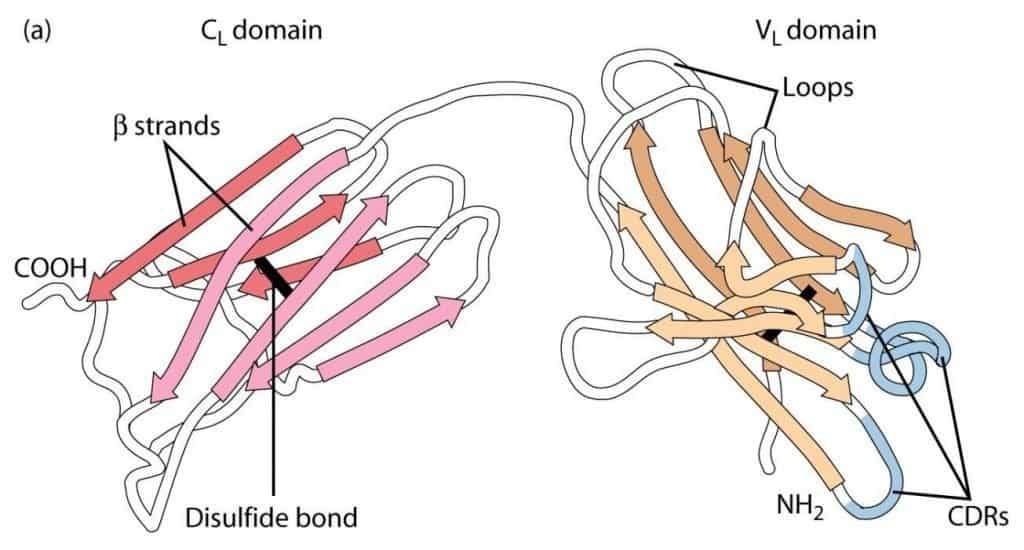
Tanto las cadenas pesadas como las ligeras presentan una unidad estructural básica (dominio inmunoglobulina), que se repite 4-5 veces en las pesadas y 2 veces en las ligeras. Este dominio está constituido por dos láminas beta, cada una integrada por 3-4 hélices alfa antiparalelas, muy estables gracias a interacciones hidrofóbicas y un puente disulfuro intradominio entre dos cisteínas, cada una perteneciente a una de las hélices de cada lámina. Las proteínas que presentan este motivo en su estructura se dice que pertenecen a la denominada superfamilia de las inmunoglobulinas.
(Reproducido de Regueiro J.R., López C., González S. & Martínez E. (2011) Inmunología. Biología y Patología del Sistema Inmune. (4ª Ed.) Editorial Médica Panamericana, Madrid.)
Estos dominios tienen una nomenclatura dependiendo de que entren o no en contacto con el antígeno (Figura 6.3). Los dominios de la zona carboxilo-terminal, se denominan constantes (C) y se hace constar si son de la cadena pesada o ligera con un subíndice (H o L): así tenemos dominios CH y CL. Los dominios amino-terminales son los responsables del reconocimiento de antígeno, son los dominios variables (V); de nuevo, la pertenencia a cadenas pesadas o ligeras se hace constar con subíndices VH y VL. Sólo en el caso de las pesadas (ya que las ligeras tienen un único dominio constante), los dominios constantes se numeran: CH1, CH2, CH3. Puede existir un dominio constante adicional (CH4) como en el caso de las IgM e IgE. Por lo tanto la cadena H se estructura en 4-5 dominios, el primero en el extremo amino-terminal es variable y los otros 3 o 4 siguientes son constantes. Las cadenas ligeras se estructuran siempre en 2: uno variable y uno constante.
Entre el primer y segundo dominios constantes de la cadena pesada existe una zona o región bisagra de longitud variable (10-60 aa), no estructurada en dominios, donde se forman los enla- ces disulfuro entre las cadenas pesadas, y que confiere flexibilidad a la Ig. Esto es lo que confie- re a la molécula su característica estructura que se abrevia como una Y. Cada Ig puede recono- cer 2 Ag iguales simultáneamente ya que cada pareja de dominios variables (VH y VL) interac- ciona con un Ag idéntico al de la otra pareja.
Cuando se somete la molécula de Ig a la acción de proteasas
vegetales (pepsina y papaína) se liberan diferentes fragmentos proteicos
(Figura 6.4):
- Papaína: se produce un corte en cada cadena pesada, a nivel de la la zona bisagra. Obtenemos 3 fragmentos: uno con los 2-3 dominios constantes de las 2 cadenas pesadas llamado fragmento cristalizable (Fc) y 2 fragmentos idénticos que incluyen los dominios variables de ambas cadenas, un dominio constante de la pesada y la cadena ligera en su totalidad; llamados Fab (antigen binding fragment, fragmento de unión al antígeno). En Fab reside la especificidad de la Ig, y Fc determina la funcionalidad de la molécula.
- Pepsina: se dan distintos puntos de corte en las cadenas pesadas. Obtenemos un gran fragmento con los dos sitios de unión al antígeno unidos, denominado F’(ab)2 y dife- rentes fragmentos de la porción constante de las cadenas pesadas denominados pFc’.
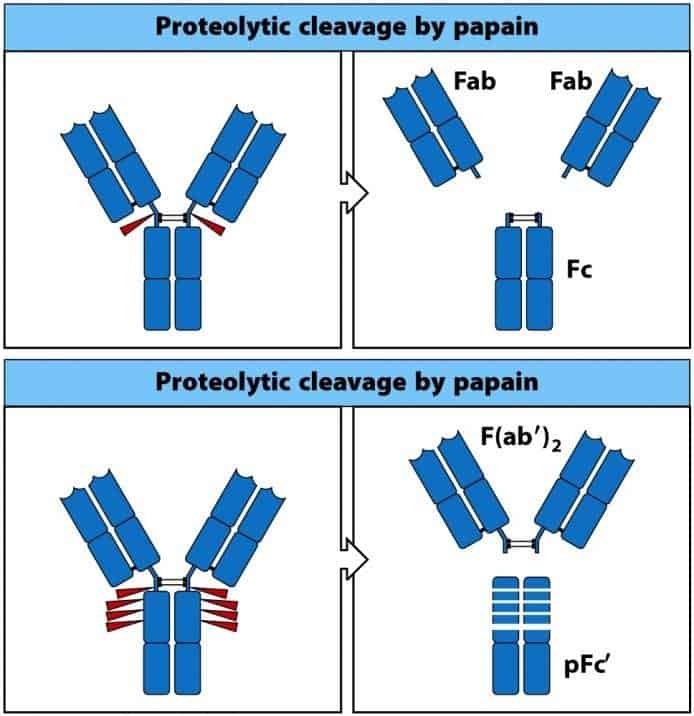
(Reproducido de Murphy K., Travers P. & Walport M. (2008) Janeway’s Immunobiology (7th Ed.) Garland Science, Nueva York.)
Responses
Lo siento, debes estar conectado para publicar un comentario.

Buenas noches. Excelente su página y su curso. Muchas gracias. Les comento que en la Figura 6.4 dice papaina en ambos gráficos (en el de abajo debería decir pepsina). Saludos desde Colombia.