Inmunología Humana
-
INTRODUCCIÓN AL SISTEMA INMUNE HUMANOIntroducción. Conceptos básicos10 Temas
-
Introducción Inmunología
-
Funciones sistema inmune y barreras de defensa
-
Inmunidad innata vs adaptativa
-
Respuesta humoral vs celular
-
Respuesta adaptativa primaria vs secundaria
-
Características de la respuesta inmunitaria adaptativa
-
Concepto de antígeno
-
La respuesta inmunitaria específica es clonal
-
Revisión de los componentes del sistema inmunitario
-
Patología general del sistema inmunitario
-
Introducción Inmunología
-
Células del sistema inmune y diferenciación celular6 Temas
-
Hematopoyesis
-
Las células sanguíneas (I): Granulocitos y Mastocitos
-
Las células sanguíneas (II): Plaquetas, Eritrocitos, Monocitos y Macrófagos
-
Las células sanguíneas (III): Linfocitos (T y B), Células plasmáticas y LGL (Linfocitos NK)
-
Las células sanguíneas (IV): Células dendríticas y proporciones relativas de los tipos celulares
-
Funciones y gestión de receptores para antígenos
-
Hematopoyesis
-
Tejidos del sistema inmune: órganos linfoides 1º y 2º3 Temas
-
Células y mecanismos de la inmunidad innata (I): macrófagos, receptores y mecanismos efectores5 Temas
-
Células y mecanismos de la inmunidad innata (II): linfocitos NK, receptores y mecanismos efectores4 Temas
-
MOLÉCULAS IMPLICADAS EN EL RECONOCIMIENTO DE ANTÍGENOEl receptor de antígeno del linfocito B6 Temas
-
Inmunoglobulinas (I): Formas en la naturaleza, estructura y dominio básico
-
Inmunoglobulinas (II): Clases, formas, variabilidad y tejidos
-
Inmunoglobulinas (III): Enlaces antígeno-anticuerpo y funciones
-
Inmunoglobulinas (IV): Receptores para inmunoglobulinas
-
Inmunoglobulinas (V): Procesamiento de RNA, receptor del linfocito B, complejo co-receptor y activación célula B
-
Inmunoglobulinas (VI): Desarrollo / Diferenciación células B
-
Inmunoglobulinas (I): Formas en la naturaleza, estructura y dominio básico
-
El receptor de antígeno del linfocito T4 Temas
-
Mecanismos de generación de la diversidad de linfocitos T y B9 Temas
-
Genes para las cadenas pesadas y ligeras: Diversidad potencial
-
Reordenamiento de los genes
-
Mecanismos de amplificación de la diversidad
-
Expresión de las inmunoglobulinas en el BCR
-
Maduración de los linfocitos B
-
La cooperación T-B
-
Anomalías/Problemas en el proceso (CLÍNICA)
-
Maduración de los linfocitos B
-
Variabilidad en el repertorio del TcR en linfocitos T
-
Genes para las cadenas pesadas y ligeras: Diversidad potencial
-
El complejo principal de histocompatibilidad (I): estructura proteica, genética y nomenclatura3 Temas
-
El complejo principal de histocompatibilidad (II): Procesamiento y presentación de antígeno, polimorfismo y aplicaciones clínicas5 Temas
-
MOLÉCULAS ACCESORIAS DE LA RESPUESTA INMUNEEl sistema del complemento y sus receptores (I): vía clásica y vía alternativa4 Temas
-
El sistema del complemento y sus receptores (II): vía de las lectinas, vía lítica y regulación3 Temas
-
Moléculas implicadas en la comunicación intercelular (I): citocinas y sus receptores5 Temas
-
Moléculas implicadas en la comunicación intercelular (II): moléculas de adhesión y sus ligandos3 Temas
-
EL SISTEMA INMUNE EN ACCIÓN BLOQUEGeneración de linfocitos T efectores4 Temas
-
Generación de linfocitos B efectores7 Temas
-
Sistema Inmune asociado a mucosas (MALT)9 Temas
-
Introducción MALT
-
Estructura del tejido linfoide asociado a la mucosa intestinal
-
Recirculación y migración selectiva de linfocitos al intestino
-
Barrera epitelial intestinal: Función Inmunológica
-
Receptores para el reconocimiento de patrones moleculares
-
Inmunoglobulinas Poliméricas: IgM + IgA
-
Vías de entrada del antígeno en el intestino
-
Diferenciación de los linfocitos T efectores MALT
-
Tolerancia Oral ante antígenos solubles
-
Introducción MALT
-
La respuesta inmune (I): inmunidad innata e inflamación aguda8 Temas
-
Barreras no específicas frente a infección por microorganismos patógenos
-
Principales leucocitos que paticipan en las inmunidad innata
-
La rección inflamatoria
-
Inflamación aguda
-
Sucesos del proceso inflamatorio
-
Citocinas producidas por macrófagos: efectos locales y sistémicos
-
Efectos de las citocinas en la inmunidad innata
-
Proteínas de fase aguda
-
Barreras no específicas frente a infección por microorganismos patógenos
-
La respuesta inmune (II): mecanismos de la inmunidad específica8 Temas
-
La respuesta inmune (III): respuesta frente a virus, bacterias y hongos, protozoos y helmintos9 Temas
-
Principales enfermedades infecciosas mortales
-
Patógenos infecciosos
-
Respuestas frente a bacterias extracelulares
-
Respuesta frente a bacterias intracelulares
-
Proceso de fagocitosis
-
Respuestas frente a protozoos y helmintos
-
Ciclo vital del plasmodium
-
Respuestas inmunitarias frente a virus
-
Mecanismos de evasión inmunitaria. Virales y bacterianos.
-
Principales enfermedades infecciosas mortales
-
REGULACIÓN e INTRODUCCIÓN A LA INMUNOPATOLOGÍARegulación de la respuesta inmune (I): regulación por moléculas8 Temas
-
Regulación de la respuesta inmune: Introducción
-
Regulación por moléculas: el complemento (I)
-
Proteínas reguladoras del complemento y proceso de regulación (II)
-
Proceso de regulación por complemento (III)
-
Regulación de los anticuerpos preformados
-
Regulación por anticuerpos: Redes idiotípicas
-
Regulación por moléculas de linfocitos T
-
Regulación a nivel bioquímico: ITAM frente a ITIM
-
Regulación de la respuesta inmune: Introducción
-
Regulación de la respuesta inmune (II): regulación por células y sistemas4 Temas
-
El sistema inmune a lo largo del ciclo vital: Inmunosenescencia6 Temas
-
Introducción a la inmunopatología13 Temas
-
Conceptos básicos
-
Inmunodeficiencias
-
Las Inmunodeficiencias (II): Déficits de Complemento
-
Las Inmunodeficiencias (III): Déficits de citocinas en receptores
-
Las Inmunodeficiencias (IV): Déficits de TLR's
-
Las Inmunodeficiencias (V): Déficits de función fagocitaria
-
Las Inmunodeficiencias (VI): Déficit de linfocitos B
-
Las Inmunodeficiencias (VII): Déficits de linfocitos T
-
Inmunodeficiencias primarias (IDP's): Clínica y Diagnóstico
-
Hipersensibilidades
-
Autoinmunidad
-
Trasplantes. Rechazo
-
Inmunidad frente a tumores
-
Conceptos básicos
-
Introducción a la Inmunoterapia8 Temas
-
Vacunas (I): Bases inmunológicas
-
Vacunas (II): Tipos de vacunas
-
Inmunoterapia frente a enfermedades autoinmunes
-
Anticuerpos monoclonales en la terapia del cáncer
-
Otras estrategias anti-tumorales
-
Tratamiento “clásico” de la patología alérgica
-
Inmunoterapia en el trasplante de órganos
-
Tratamiento de inmunodeficiencias primarias
-
Vacunas (I): Bases inmunológicas
Receptores para la fagocitosis
Aquí tienes el temario explicado en el vídeo anterior. Si tienes alguna duda plantéala en el sistema de comentarios del final de la página.
Tipos de receptores y ligandos
Existen fundamentalmente dos tipos de receptores fagocíticos (Figura 4.4):
- Receptores endocíticos, cuya función es mediar la fagocitosis.
- Receptores de señalización, inductores de respuestas inflamatorias contra el patógeno.
El reconocimiento de antígenos mediante receptores endocíticos, el primer gran grupo de receptores fagocíticos, lleva a la internalización y fusión con los lisosomas, donde se destruirán los patógenos (Figura 4.4). Además, en las células dendríticas y el sistema monocito-macrófago también es posible presentar el antígeno a través de proteínas HLA de clase II (Figura 4.5), al ser células presentadoras de antígenos (APC).
Entre los receptores endocíticos, se pueden destacar:
Receptores de reconocimiento de patrones moleculares:
- MR reconoce la manosa, un carbohidrato muy habitual en glucoproteínas y glucolípidos bacterianos y virales.
- LPSR (CD14), junto con un TLR, reconoce los lipopolisacáridos de las bacterias grammnegativas.
- SR reconoce desechos de bacterias grammpositivas, grammnegativas o células apoptóticas.
- MBL (lectina unidora de manosas) se une a manosas y fucosas de las paredes bacterianas e inicia la vía de las lectinas de activación del complemento.
- Receptores para moléculas adaptadoras (opsoninas): los receptores de reconocimiento de patrones moleculares son inútiles cuando el patógeno carece de polisacáridos en su cápsula. Por ello, solo pueden ser fagocitados sin están opsonizados por moléculas adaptadoras (inmunoglobulinas y fragmentos de complemento). Los fagocitos pueden reconocer a patógenos opsonizados mediante las siguientes opsoninas:
- Inmunoglobulina G, reconocida por los receptores FcγRI, RII y RIII de los fa- gocitos.
- Fragmento C3b del complemento: reconocida por los receptores CR1, CR3 y CR4 de las células fagocíticas.
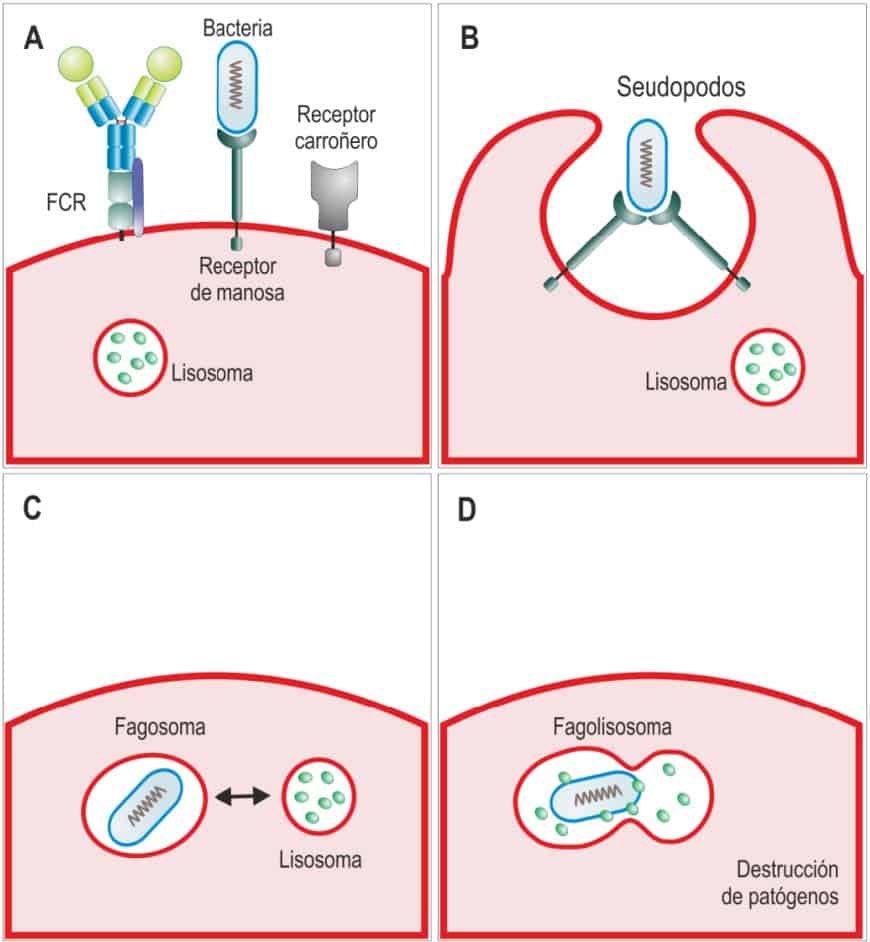
El reconocimiento como extraños de los microorganismos por los receptores de los fagocitos lleva a su internalización en los fagosomas que al fusionarse con los lisosomas forman los fagolisoso- mas en cuyo interior son destruidos los microorganismos. (Reproducido de Regueiro J.R., López C., González S. & Martínez E. (2011) Inmunología. Biología y Patología del Sistema Inmune. (4ª
Ed.) Editorial Médica Panamericana, Madrid.)
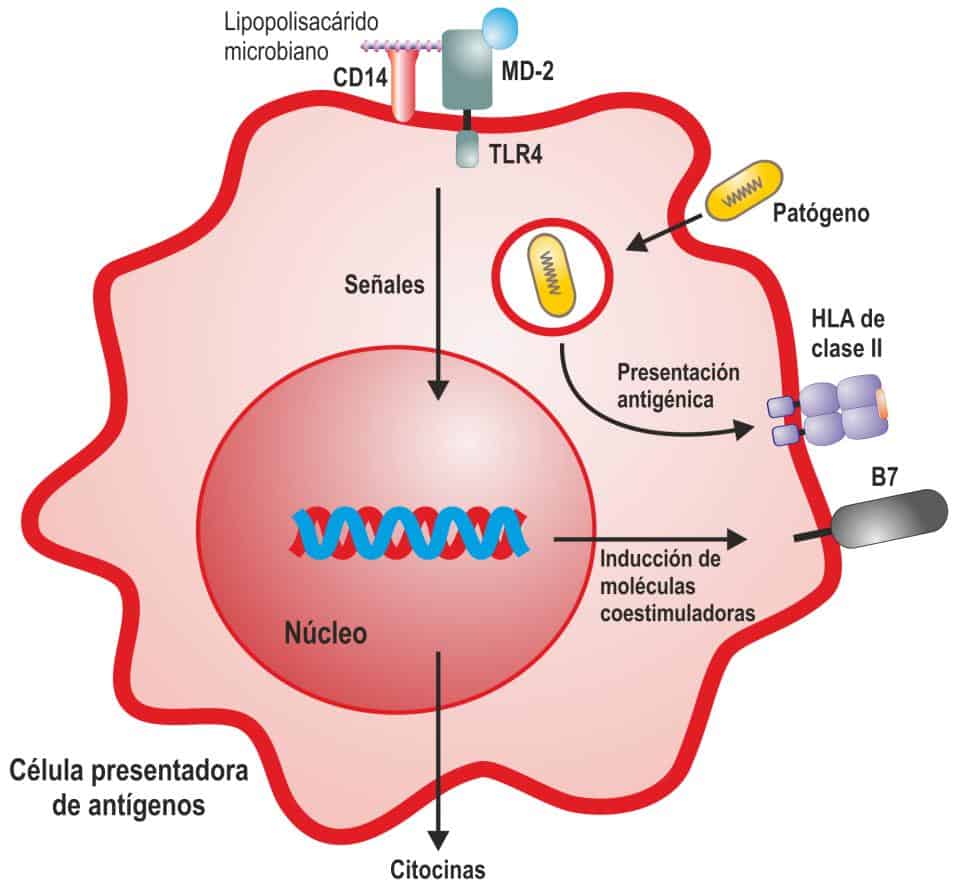
Los macrófagos participan en la inflamación y en la activación de los linfocitos T. El reconocimiento de los patógenos por los receptores de señalización (tipo Toll o TLR) transduce una serie de señales al interior del núcleo celular, que genera la síntesis y secreción de citocinas que participan en el inicio de la respuesta inflamatoria y la respuesta inmunitaria adaptativa. Además, los patógenos fagocitados son procesados y presentados en forma de péptidos a los linfocitos T por las moléculas del MHC o HLA. Los linfocitos T para activarse deben de reconocer el péptido extraño y recibir una segunda señal proveniente de una serie de moléculas coestimuladoras que se expresan en la superficie de los fagocitos cuando los receptores de señalización reconocen a los microorganismos. (Reproducido de Regueiro J.R., López C., González S. & Martínez E. (2011) Inmunología.
Biología y Patología del Sistema Inmune. (4ª Ed.) Editorial Médica Panamericana, Madrid.)
Los receptores de señalización, que constituyen el segundo gran grupo de receptores fagocíti- cos, se reparten entre la superficie, los endosomas o incluso libres en el citoplasma celular. Reconocen patrones moleculares asociados a patógenos (PAMP), y hay varias familias de este tipo de receptores, siendo una de las más importantes los receptores tipo Toll (TLR).
Toll-Like Receptors (TLR)
Los Toll-Like Receptors o receptores tipo toll poseen un
dominio extracelular que contiene muchas repeticiones ricas en leucina (LRR),
un dominio transmembrana y un dominio interior o dominio TIR (Figura 4.6). El
dominio TIR interactúa con otros miembros de la vía de transduc- ción de
señales de los TLRs, como MyD88 (Figura 4.7).
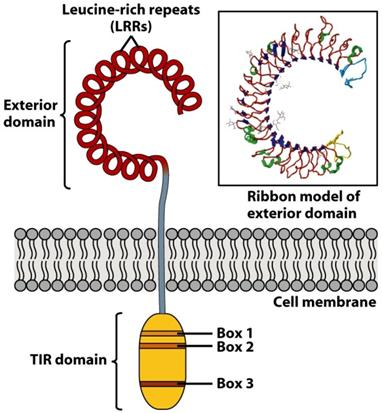
(Reproducido de Kindt T.J., Goldsby R.A., Osborne B.A. & Palacios R. (2007) Inmunología de Kuby (6ª Ed.) McGraw-Hill Interamericana, Madrid.)
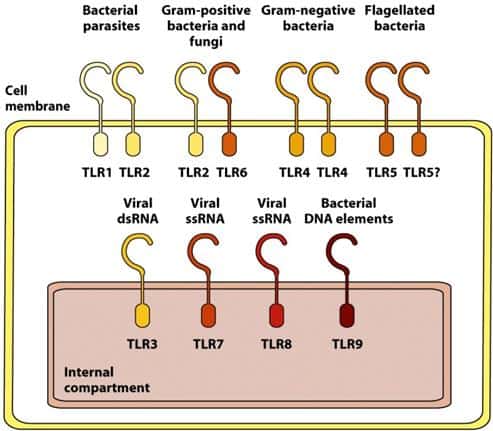
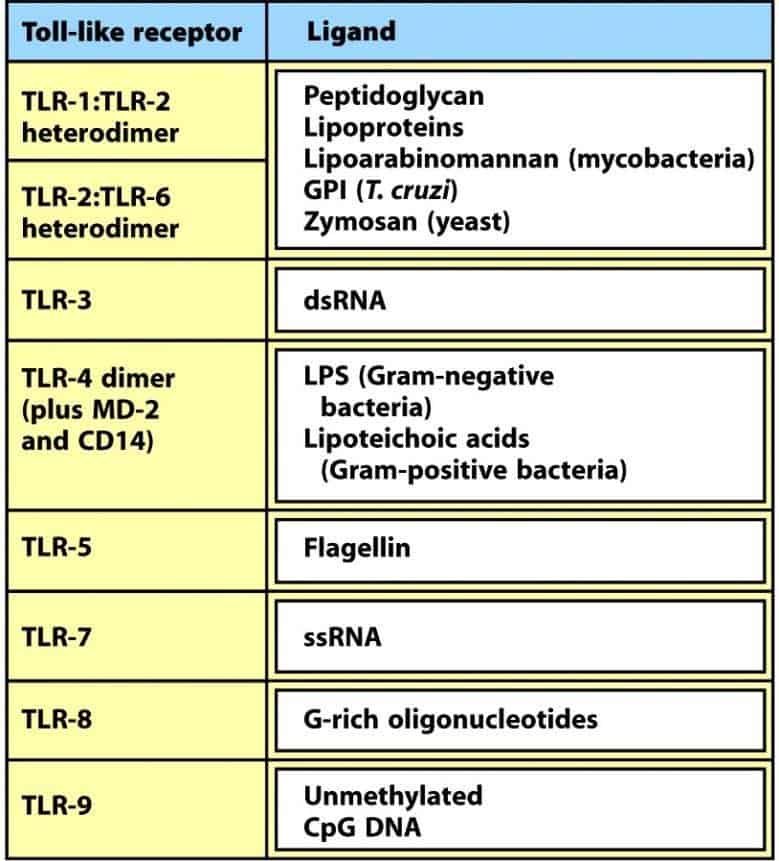
Se conocen 10 TLRs en humanos, cada uno de ellos capaz de reconocer un set diferente de pa- trones moleculares de patógenos (PAMPs) que no existen normalmente en vertebrados. Debido a que sólo hay 10 proteínas diferentes, su especificidad es limitada, pero pueden reconocer mo- léculas de muy diferentes patógenos.
Algunos TLRs se expresan en la superficie celular (los que
reconocen proteínas, peptidoglica- nos, lipoproteínas o LPS), en tanto que
otros se expresan en la membrana de endosomas (Figura 4.7), donde detectan
fragmentos de patógenos que han sido previamente endocitados.
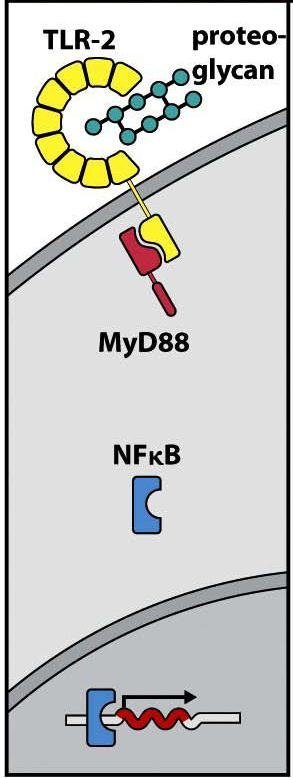
Reconocimiento de proteoglicanos por TLR 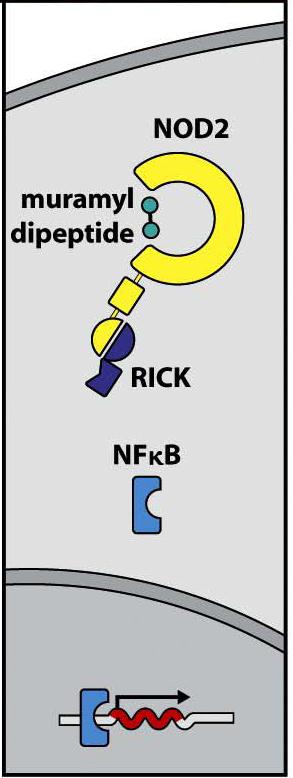
Reconocimiento de proteoglicanos por NOR
(Reproducido de Murphy K et al. (2008) Janeway’s Immunobiology (7th Ed.) Garland Science, Nueva York.)
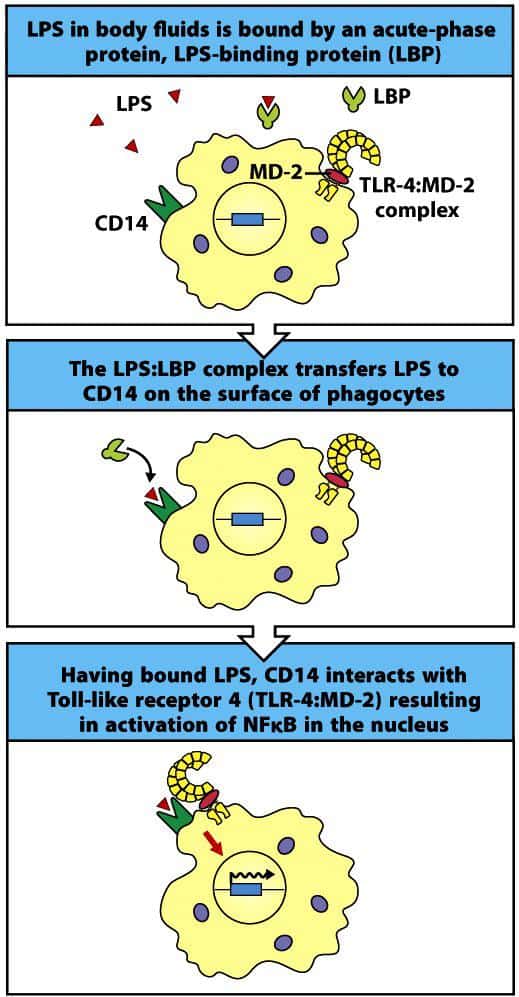
Los TLRs endosomales reconocen fundamentalmente diferentes formas de ácidos nucleicos de los microorganismos. Pueden actuar como heterodímeros, homodímeros, monómeros o incluso en el caso de TLR-4, mediante la asociación a las proteínas CD14 y MD-2 para reconocer el LPS unido a una proteína unidora de LPS (fase aguda de una infección) (Figura 4.8).
(Reproducido de Murphy K et al. (2008) Janeway’s Immunobiology (7th Ed.) Garland Science, Nueva York.)
Otra familia de receptores similares a los TLRs pero de distribución citosólica son los recepto- res NOD (Nucleotide-binding Oligomerization Domain), que se unen a productos bacterianos libres en el citoplasma (Figura 4.7). La señalización inducida por TLRs y NOD tiene unos me- diadores diferenciales y otros comunes. Sin embargo, en ambos casos se activa el factor de transcripción nuclear NFκB, que se transloca al núcleo e induce la síntesis de citocinas y otras proteínas del proceso inflamatorio (Figura 4.9).
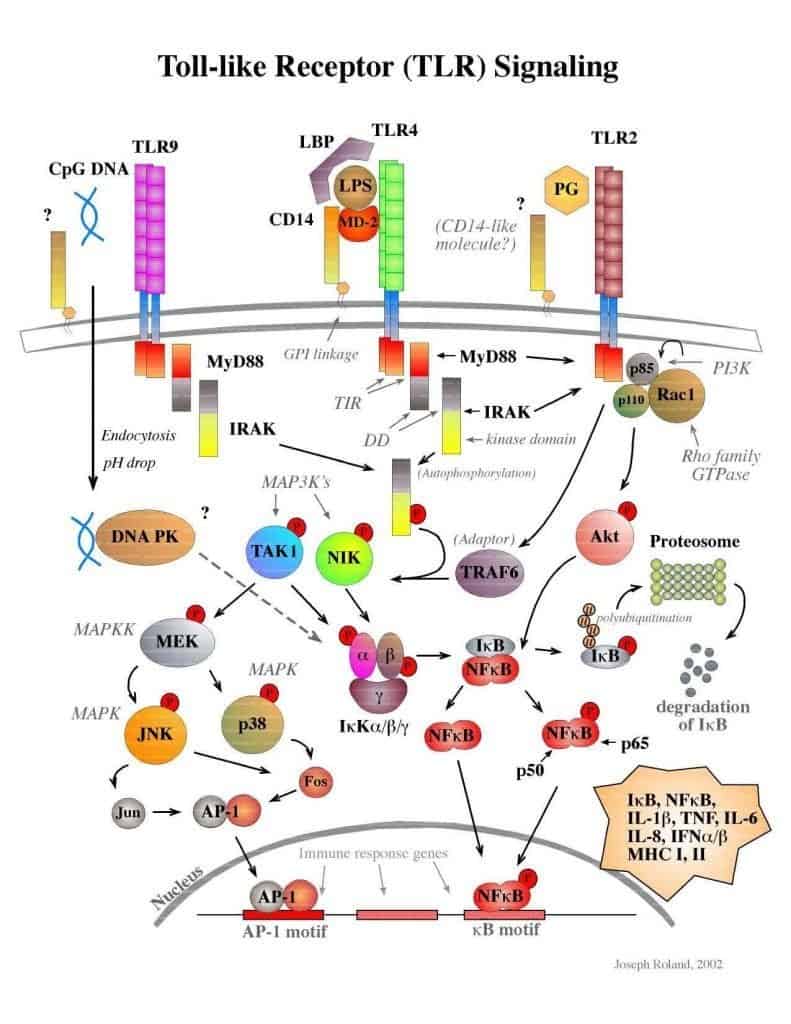
(Cortesía de Joseph Roland.)

Responses