Inmunología Humana
-
INTRODUCCIÓN AL SISTEMA INMUNE HUMANOIntroducción. Conceptos básicos10 Temas
-
Introducción Inmunología
-
Funciones sistema inmune y barreras de defensa
-
Inmunidad innata vs adaptativa
-
Respuesta humoral vs celular
-
Respuesta adaptativa primaria vs secundaria
-
Características de la respuesta inmunitaria adaptativa
-
Concepto de antígeno
-
La respuesta inmunitaria específica es clonal
-
Revisión de los componentes del sistema inmunitario
-
Patología general del sistema inmunitario
-
Introducción Inmunología
-
Células del sistema inmune y diferenciación celular6 Temas
-
Hematopoyesis
-
Las células sanguíneas (I): Granulocitos y Mastocitos
-
Las células sanguíneas (II): Plaquetas, Eritrocitos, Monocitos y Macrófagos
-
Las células sanguíneas (III): Linfocitos (T y B), Células plasmáticas y LGL (Linfocitos NK)
-
Las células sanguíneas (IV): Células dendríticas y proporciones relativas de los tipos celulares
-
Funciones y gestión de receptores para antígenos
-
Hematopoyesis
-
Tejidos del sistema inmune: órganos linfoides 1º y 2º3 Temas
-
Células y mecanismos de la inmunidad innata (I): macrófagos, receptores y mecanismos efectores5 Temas
-
Células y mecanismos de la inmunidad innata (II): linfocitos NK, receptores y mecanismos efectores4 Temas
-
MOLÉCULAS IMPLICADAS EN EL RECONOCIMIENTO DE ANTÍGENOEl receptor de antígeno del linfocito B6 Temas
-
Inmunoglobulinas (I): Formas en la naturaleza, estructura y dominio básico
-
Inmunoglobulinas (II): Clases, formas, variabilidad y tejidos
-
Inmunoglobulinas (III): Enlaces antígeno-anticuerpo y funciones
-
Inmunoglobulinas (IV): Receptores para inmunoglobulinas
-
Inmunoglobulinas (V): Procesamiento de RNA, receptor del linfocito B, complejo co-receptor y activación célula B
-
Inmunoglobulinas (VI): Desarrollo / Diferenciación células B
-
Inmunoglobulinas (I): Formas en la naturaleza, estructura y dominio básico
-
El receptor de antígeno del linfocito T4 Temas
-
Mecanismos de generación de la diversidad de linfocitos T y B9 Temas
-
Genes para las cadenas pesadas y ligeras: Diversidad potencial
-
Reordenamiento de los genes
-
Mecanismos de amplificación de la diversidad
-
Expresión de las inmunoglobulinas en el BCR
-
Maduración de los linfocitos B
-
La cooperación T-B
-
Anomalías/Problemas en el proceso (CLÍNICA)
-
Maduración de los linfocitos B
-
Variabilidad en el repertorio del TcR en linfocitos T
-
Genes para las cadenas pesadas y ligeras: Diversidad potencial
-
El complejo principal de histocompatibilidad (I): estructura proteica, genética y nomenclatura3 Temas
-
El complejo principal de histocompatibilidad (II): Procesamiento y presentación de antígeno, polimorfismo y aplicaciones clínicas5 Temas
-
MOLÉCULAS ACCESORIAS DE LA RESPUESTA INMUNEEl sistema del complemento y sus receptores (I): vía clásica y vía alternativa4 Temas
-
El sistema del complemento y sus receptores (II): vía de las lectinas, vía lítica y regulación3 Temas
-
Moléculas implicadas en la comunicación intercelular (I): citocinas y sus receptores5 Temas
-
Moléculas implicadas en la comunicación intercelular (II): moléculas de adhesión y sus ligandos3 Temas
-
EL SISTEMA INMUNE EN ACCIÓN BLOQUEGeneración de linfocitos T efectores4 Temas
-
Generación de linfocitos B efectores7 Temas
-
Sistema Inmune asociado a mucosas (MALT)9 Temas
-
Introducción MALT
-
Estructura del tejido linfoide asociado a la mucosa intestinal
-
Recirculación y migración selectiva de linfocitos al intestino
-
Barrera epitelial intestinal: Función Inmunológica
-
Receptores para el reconocimiento de patrones moleculares
-
Inmunoglobulinas Poliméricas: IgM + IgA
-
Vías de entrada del antígeno en el intestino
-
Diferenciación de los linfocitos T efectores MALT
-
Tolerancia Oral ante antígenos solubles
-
Introducción MALT
-
La respuesta inmune (I): inmunidad innata e inflamación aguda8 Temas
-
Barreras no específicas frente a infección por microorganismos patógenos
-
Principales leucocitos que paticipan en las inmunidad innata
-
La rección inflamatoria
-
Inflamación aguda
-
Sucesos del proceso inflamatorio
-
Citocinas producidas por macrófagos: efectos locales y sistémicos
-
Efectos de las citocinas en la inmunidad innata
-
Proteínas de fase aguda
-
Barreras no específicas frente a infección por microorganismos patógenos
-
La respuesta inmune (II): mecanismos de la inmunidad específica8 Temas
-
La respuesta inmune (III): respuesta frente a virus, bacterias y hongos, protozoos y helmintos9 Temas
-
Principales enfermedades infecciosas mortales
-
Patógenos infecciosos
-
Respuestas frente a bacterias extracelulares
-
Respuesta frente a bacterias intracelulares
-
Proceso de fagocitosis
-
Respuestas frente a protozoos y helmintos
-
Ciclo vital del plasmodium
-
Respuestas inmunitarias frente a virus
-
Mecanismos de evasión inmunitaria. Virales y bacterianos.
-
Principales enfermedades infecciosas mortales
-
REGULACIÓN e INTRODUCCIÓN A LA INMUNOPATOLOGÍARegulación de la respuesta inmune (I): regulación por moléculas8 Temas
-
Regulación de la respuesta inmune: Introducción
-
Regulación por moléculas: el complemento (I)
-
Proteínas reguladoras del complemento y proceso de regulación (II)
-
Proceso de regulación por complemento (III)
-
Regulación de los anticuerpos preformados
-
Regulación por anticuerpos: Redes idiotípicas
-
Regulación por moléculas de linfocitos T
-
Regulación a nivel bioquímico: ITAM frente a ITIM
-
Regulación de la respuesta inmune: Introducción
-
Regulación de la respuesta inmune (II): regulación por células y sistemas4 Temas
-
El sistema inmune a lo largo del ciclo vital: Inmunosenescencia6 Temas
-
Introducción a la inmunopatología13 Temas
-
Conceptos básicos
-
Inmunodeficiencias
-
Las Inmunodeficiencias (II): Déficits de Complemento
-
Las Inmunodeficiencias (III): Déficits de citocinas en receptores
-
Las Inmunodeficiencias (IV): Déficits de TLR's
-
Las Inmunodeficiencias (V): Déficits de función fagocitaria
-
Las Inmunodeficiencias (VI): Déficit de linfocitos B
-
Las Inmunodeficiencias (VII): Déficits de linfocitos T
-
Inmunodeficiencias primarias (IDP's): Clínica y Diagnóstico
-
Hipersensibilidades
-
Autoinmunidad
-
Trasplantes. Rechazo
-
Inmunidad frente a tumores
-
Conceptos básicos
-
Introducción a la Inmunoterapia8 Temas
-
Vacunas (I): Bases inmunológicas
-
Vacunas (II): Tipos de vacunas
-
Inmunoterapia frente a enfermedades autoinmunes
-
Anticuerpos monoclonales en la terapia del cáncer
-
Otras estrategias anti-tumorales
-
Tratamiento “clásico” de la patología alérgica
-
Inmunoterapia en el trasplante de órganos
-
Tratamiento de inmunodeficiencias primarias
-
Vacunas (I): Bases inmunológicas
Vías del complemento (III): Vía Lítica
Aquí tienes el temario explicado en el vídeo anterior. Si tienes alguna duda plantéala en el sistema de comentarios del final de la página.
La vía lítica
La formación de las convertasas de C3 es el punto de convergencia de las tres vías de activación del complemento. En adelante, la convertasa de la vía clásica y de las lectinas (C4b2b), y la convertasa de la vía alternativa (C3bBb), inician una serie de eventos comunes que, en su con- junto se denominan vía lítica o vía final común. La vía final común permite la formación de un complejo de ataque a la membrana (MAC), que produce un poro en la bicapa lipídica del patógeno, alterando su integridad y dando lugar a un shock osmótico que produce la muerte del microorganismo.
El primer paso para la formación del MAC es la formación de las convertasas de C5 (Figura 11.10). La convertasa de C5 de la vía clásica y de las lectinas se forma por la unión de C3b a C4b2, que da lugar a C4b2b3b. La convertasa de C5 de la vía alternativa se forma por la unión de C3b a C3bBb, que da lugar a C3bBb3b (o C3b2Bb). Cualquiera de las convertasas de C5 puede unir e hidrolizar C5 gracias al sitio de unión disponible para ello en C3b y a la actividad serinprotasa de C2b o Bb. A partir de esta reacción se produce C5a y C5b. A partir de este pun- to, el resto de componentes se añaden en serie (Figura 11.11).
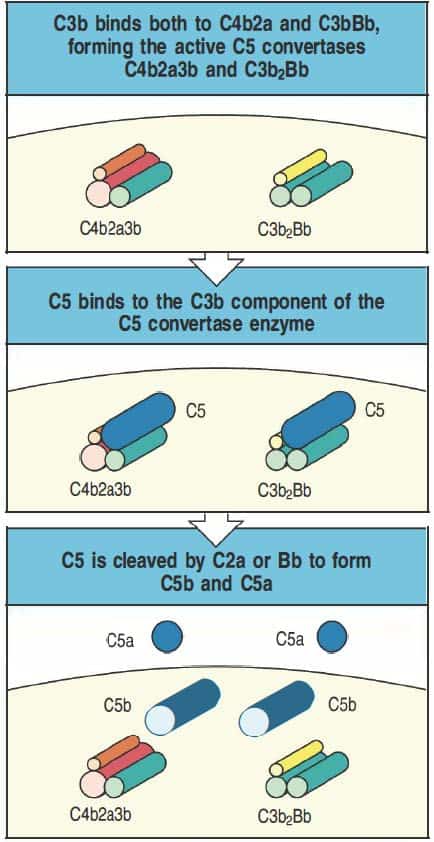
(Reproducido de Murphy K et al. (2012) Janeway’s Immunobiology (8th Ed.) Garland Science, Nueva York.)
En los pasos siguientes, C5b inicia el ensamblado de los componentes que formarán el MAC y dirige su inserción hacia la membrana celular. En primer lugar, C5b se une a la molécula C6, y el complejo C5b6 se une a una molécula de C7. Esta reacción desencadena un cambio conformacional en las moléculas que forman el complejo, permitiendo la exposición de un sitio hidrofóbico en C7, que permite la inserción del complejo en la bicapa lipídica.
A continuación C8, un complejo formado por las proteínas C8β y C8α-γ, se une a través de la porción C8β a la porción C5b del complejo C5b67, de manera que el dominio hidrofóbico de la porción C8α-γ permite la inserción en la bicapa lipídica.
Por último, C8α-γ induce la polimerización de entre 10 y 16 moléculas de C9 para formar una estructura denominada complejo de ataque a la membrana (MAC). El MAC tiene una región externa hidrofóbica, que permite su asociación a la bicapa lipídica, y un canal hidrofílico interno de 100 Å de diámetro, que permite el paso de agua y solutos libremente a través de la bicapa lipídica. La disrupción de la bicapa lipídica produce la pérdida de la homeostasis celular y del gradiente de protones a través de la membrana, y permite la entrada de enzimas proteolíticas al interior, terminando con la destrucción del patógeno.
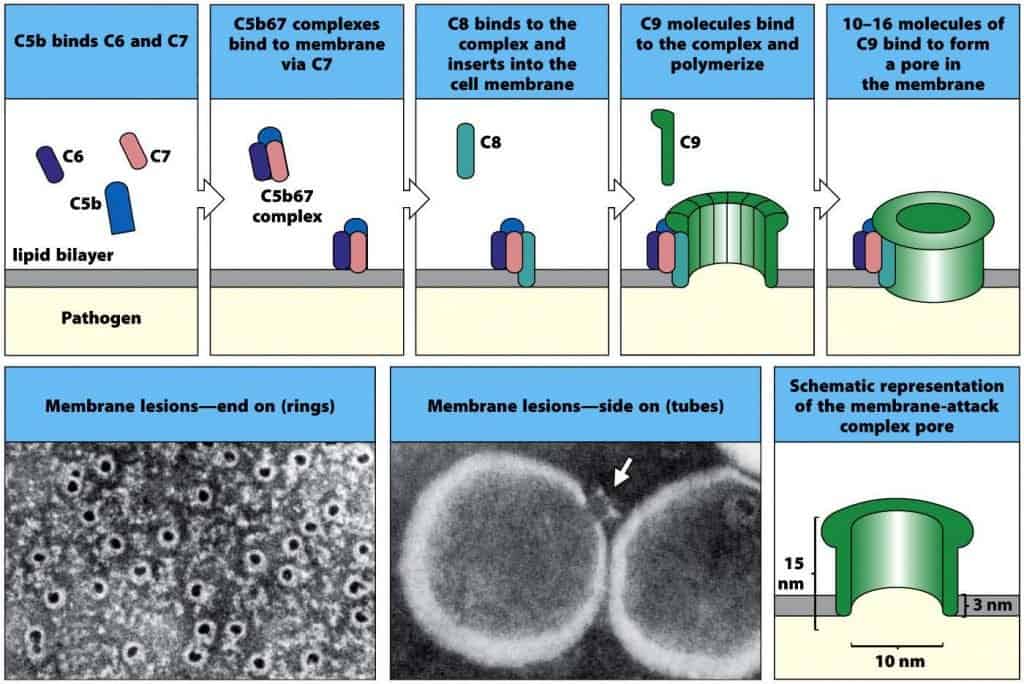
(Reproducido de Murphy K et al. (2012) Janeway’s Immunobiology (8th Ed.) Garland Science, Nueva York.)
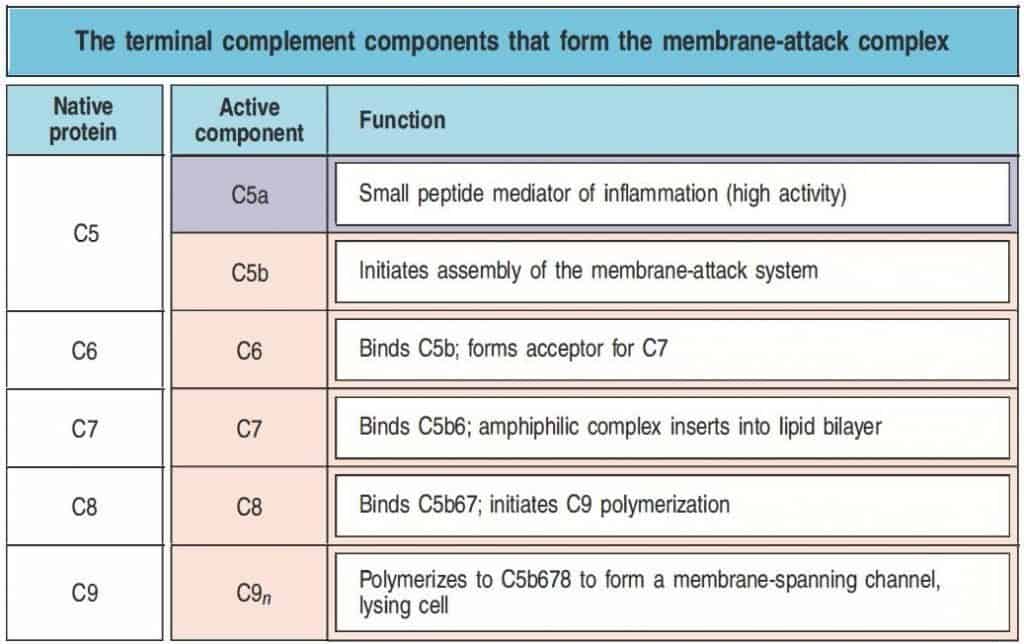
(Reproducido de Murphy K et al. (2012) Janeway’s Immunobiology (8th Ed.) Garland Science, Nueva York.)
