Inmunología Humana
-
INTRODUCCIÓN AL SISTEMA INMUNE HUMANOIntroducción. Conceptos básicos10 Temas
-
Introducción Inmunología
-
Funciones sistema inmune y barreras de defensa
-
Inmunidad innata vs adaptativa
-
Respuesta humoral vs celular
-
Respuesta adaptativa primaria vs secundaria
-
Características de la respuesta inmunitaria adaptativa
-
Concepto de antígeno
-
La respuesta inmunitaria específica es clonal
-
Revisión de los componentes del sistema inmunitario
-
Patología general del sistema inmunitario
-
Introducción Inmunología
-
Células del sistema inmune y diferenciación celular6 Temas
-
Hematopoyesis
-
Las células sanguíneas (I): Granulocitos y Mastocitos
-
Las células sanguíneas (II): Plaquetas, Eritrocitos, Monocitos y Macrófagos
-
Las células sanguíneas (III): Linfocitos (T y B), Células plasmáticas y LGL (Linfocitos NK)
-
Las células sanguíneas (IV): Células dendríticas y proporciones relativas de los tipos celulares
-
Funciones y gestión de receptores para antígenos
-
Hematopoyesis
-
Tejidos del sistema inmune: órganos linfoides 1º y 2º3 Temas
-
Células y mecanismos de la inmunidad innata (I): macrófagos, receptores y mecanismos efectores5 Temas
-
Células y mecanismos de la inmunidad innata (II): linfocitos NK, receptores y mecanismos efectores4 Temas
-
MOLÉCULAS IMPLICADAS EN EL RECONOCIMIENTO DE ANTÍGENOEl receptor de antígeno del linfocito B6 Temas
-
Inmunoglobulinas (I): Formas en la naturaleza, estructura y dominio básico
-
Inmunoglobulinas (II): Clases, formas, variabilidad y tejidos
-
Inmunoglobulinas (III): Enlaces antígeno-anticuerpo y funciones
-
Inmunoglobulinas (IV): Receptores para inmunoglobulinas
-
Inmunoglobulinas (V): Procesamiento de RNA, receptor del linfocito B, complejo co-receptor y activación célula B
-
Inmunoglobulinas (VI): Desarrollo / Diferenciación células B
-
Inmunoglobulinas (I): Formas en la naturaleza, estructura y dominio básico
-
El receptor de antígeno del linfocito T4 Temas
-
Mecanismos de generación de la diversidad de linfocitos T y B9 Temas
-
Genes para las cadenas pesadas y ligeras: Diversidad potencial
-
Reordenamiento de los genes
-
Mecanismos de amplificación de la diversidad
-
Expresión de las inmunoglobulinas en el BCR
-
Maduración de los linfocitos B
-
La cooperación T-B
-
Anomalías/Problemas en el proceso (CLÍNICA)
-
Maduración de los linfocitos B
-
Variabilidad en el repertorio del TcR en linfocitos T
-
Genes para las cadenas pesadas y ligeras: Diversidad potencial
-
El complejo principal de histocompatibilidad (I): estructura proteica, genética y nomenclatura3 Temas
-
El complejo principal de histocompatibilidad (II): Procesamiento y presentación de antígeno, polimorfismo y aplicaciones clínicas5 Temas
-
MOLÉCULAS ACCESORIAS DE LA RESPUESTA INMUNEEl sistema del complemento y sus receptores (I): vía clásica y vía alternativa4 Temas
-
El sistema del complemento y sus receptores (II): vía de las lectinas, vía lítica y regulación3 Temas
-
Moléculas implicadas en la comunicación intercelular (I): citocinas y sus receptores5 Temas
-
Moléculas implicadas en la comunicación intercelular (II): moléculas de adhesión y sus ligandos3 Temas
-
EL SISTEMA INMUNE EN ACCIÓN BLOQUEGeneración de linfocitos T efectores4 Temas
-
Generación de linfocitos B efectores7 Temas
-
Sistema Inmune asociado a mucosas (MALT)9 Temas
-
Introducción MALT
-
Estructura del tejido linfoide asociado a la mucosa intestinal
-
Recirculación y migración selectiva de linfocitos al intestino
-
Barrera epitelial intestinal: Función Inmunológica
-
Receptores para el reconocimiento de patrones moleculares
-
Inmunoglobulinas Poliméricas: IgM + IgA
-
Vías de entrada del antígeno en el intestino
-
Diferenciación de los linfocitos T efectores MALT
-
Tolerancia Oral ante antígenos solubles
-
Introducción MALT
-
La respuesta inmune (I): inmunidad innata e inflamación aguda8 Temas
-
Barreras no específicas frente a infección por microorganismos patógenos
-
Principales leucocitos que paticipan en las inmunidad innata
-
La rección inflamatoria
-
Inflamación aguda
-
Sucesos del proceso inflamatorio
-
Citocinas producidas por macrófagos: efectos locales y sistémicos
-
Efectos de las citocinas en la inmunidad innata
-
Proteínas de fase aguda
-
Barreras no específicas frente a infección por microorganismos patógenos
-
La respuesta inmune (II): mecanismos de la inmunidad específica8 Temas
-
La respuesta inmune (III): respuesta frente a virus, bacterias y hongos, protozoos y helmintos9 Temas
-
Principales enfermedades infecciosas mortales
-
Patógenos infecciosos
-
Respuestas frente a bacterias extracelulares
-
Respuesta frente a bacterias intracelulares
-
Proceso de fagocitosis
-
Respuestas frente a protozoos y helmintos
-
Ciclo vital del plasmodium
-
Respuestas inmunitarias frente a virus
-
Mecanismos de evasión inmunitaria. Virales y bacterianos.
-
Principales enfermedades infecciosas mortales
-
REGULACIÓN e INTRODUCCIÓN A LA INMUNOPATOLOGÍARegulación de la respuesta inmune (I): regulación por moléculas8 Temas
-
Regulación de la respuesta inmune: Introducción
-
Regulación por moléculas: el complemento (I)
-
Proteínas reguladoras del complemento y proceso de regulación (II)
-
Proceso de regulación por complemento (III)
-
Regulación de los anticuerpos preformados
-
Regulación por anticuerpos: Redes idiotípicas
-
Regulación por moléculas de linfocitos T
-
Regulación a nivel bioquímico: ITAM frente a ITIM
-
Regulación de la respuesta inmune: Introducción
-
Regulación de la respuesta inmune (II): regulación por células y sistemas4 Temas
-
El sistema inmune a lo largo del ciclo vital: Inmunosenescencia6 Temas
-
Introducción a la inmunopatología13 Temas
-
Conceptos básicos
-
Inmunodeficiencias
-
Las Inmunodeficiencias (II): Déficits de Complemento
-
Las Inmunodeficiencias (III): Déficits de citocinas en receptores
-
Las Inmunodeficiencias (IV): Déficits de TLR's
-
Las Inmunodeficiencias (V): Déficits de función fagocitaria
-
Las Inmunodeficiencias (VI): Déficit de linfocitos B
-
Las Inmunodeficiencias (VII): Déficits de linfocitos T
-
Inmunodeficiencias primarias (IDP's): Clínica y Diagnóstico
-
Hipersensibilidades
-
Autoinmunidad
-
Trasplantes. Rechazo
-
Inmunidad frente a tumores
-
Conceptos básicos
-
Introducción a la Inmunoterapia8 Temas
-
Vacunas (I): Bases inmunológicas
-
Vacunas (II): Tipos de vacunas
-
Inmunoterapia frente a enfermedades autoinmunes
-
Anticuerpos monoclonales en la terapia del cáncer
-
Otras estrategias anti-tumorales
-
Tratamiento “clásico” de la patología alérgica
-
Inmunoterapia en el trasplante de órganos
-
Tratamiento de inmunodeficiencias primarias
-
Vacunas (I): Bases inmunológicas
Estructura antígenos HLA: Tipo I y Tipo II
Aquí tienes el temario explicado en el vídeo anterior. Si tienes alguna duda plantéala en el sistema de comentarios del final de la página.
Antígenos hla de clase I
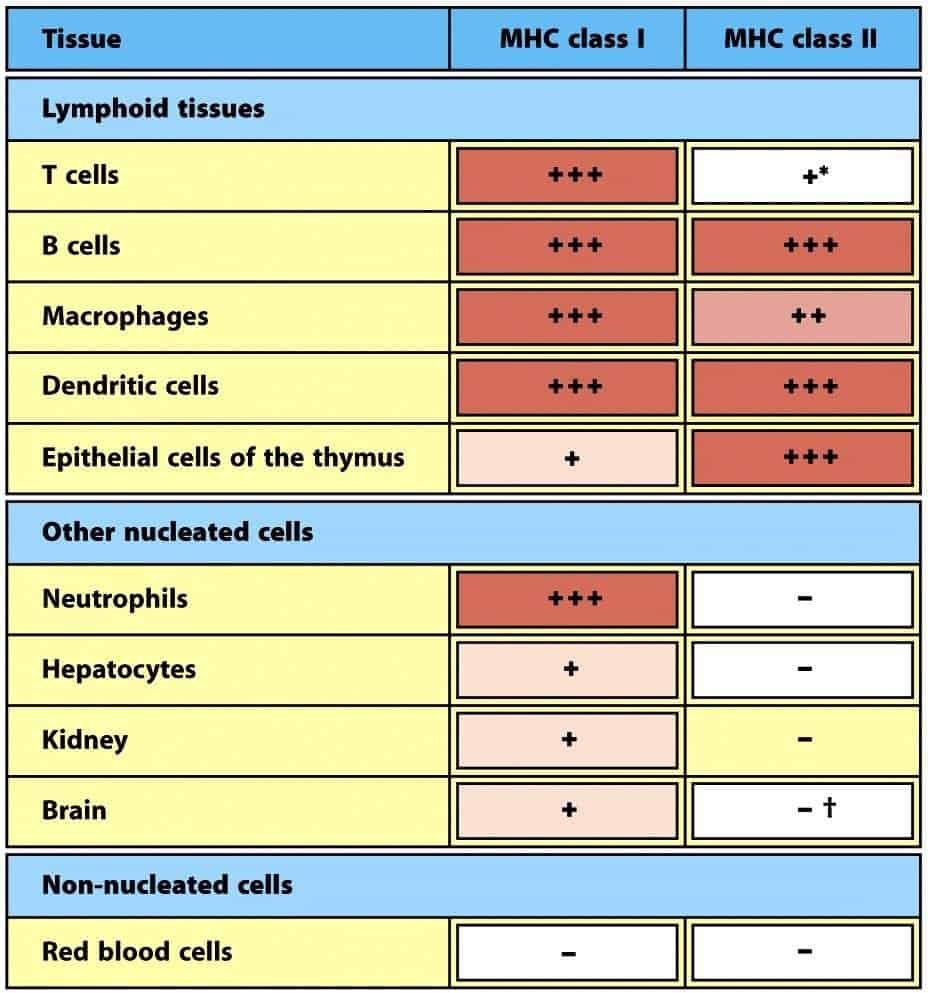
En el cromosoma 6 humano hay múltiples genes, muy polimórficos, que codifican para antíge- nos HLA de clase I clásicos: HLA –A, -B y –C. La función de estas tres proteínas es la presentación de péptidos a linfocitos Tc y su estructura es muy similar. Los antígenos HLA de clase I se expresan en todas las células del organismo excepto en los eritrocitos (Figura 9.7). Las proteínas HLA I son heterodímeros constituidos por (Figura 9.3):
- Una cadena pesada o α, que es una glicoproteica transmembranal de unos 45 kD y 300 aminoácidos. La cadena alfa tiene 3 dominios. Los dominios α1y α2, en la porción N- terminal, debido a su particular plegamiento, conforman un bolsillo o cavidad (hueco físico) de unión de péptidos. El dominio α3 es de tipo inmunoglobulina, y es la encargada de unir al antígeno HLA de clase I a la membrana plasmática.
- Una proteína soluble asociada, de forma no covalente, denominada β2-microglobulina con un único dominio (de tipo inmunoglobulina) y codificada fuera del sistema HLA.
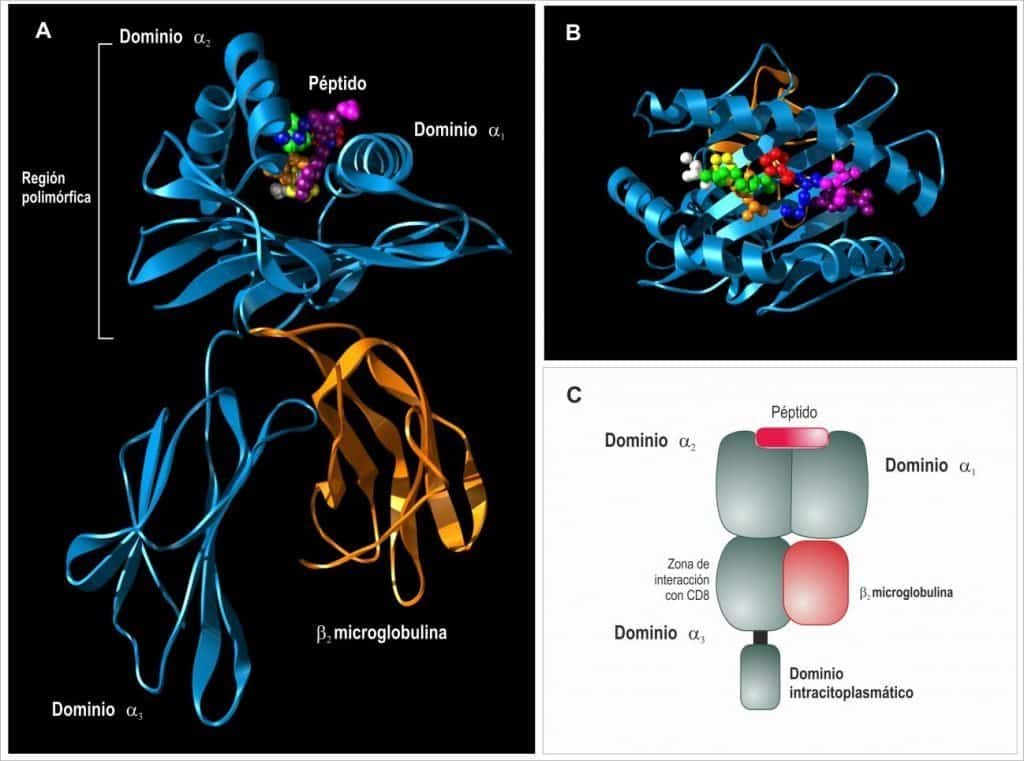
(A) Las moléculas de clase I están formadas por una cadena transmembrana denominada cadena α unida no covalentemente en su porción extracelular a una pequeña proteína denominada β2- microglobulina. (B) Los dominios α1 y α2 forman una región que une péptidos denominada hendi- dura peptídica que interacciona con TCRαβ. (C) El dominio α3 interacciona con el correceptor CD8 por donde se indica. (Reproducido de Regueiro J.R., López C., González S. & Martínez E.
(2011) Inmunología. Biología y Patología del Sistema Inmune. (4ª Ed.) Editorial Médica Paname- ricana, Madrid.)
Cavidad de unión de péptidos
La cavidad de unión de péptidos está formada por los dominios α1 y α2 que construyen una base plana al plegarse en forma de láminas β antiparalelas sobre la que descansan dos estructuras en hélice α.
Para que una proteína HLA de clase I se exprese en la superficie celular, la cavidad de unión de péptidos tiene que estar rellena por un péptido antigénico. Si este bolsillo no se rellena, la proteína no se puede expresar. Cuando se empezaron a estudiar estas proteínas y se aislaban, purificaban y cristalizaban para analizar su estructura, se pensó que los cristales no eran válidos por estar siempre “contaminados” por un péptido. Posteriormente se supo que no se trataba de una contaminación, sino que el péptido formaba parte de la estructura completa de la proteína.
Restricción por HLA
El reconocimiento de antígenos por parte de las células T
se halla restringido por el sistema HLA. El receptor específico de antígeno de
las células T (TCR, T-cell receptor) reconoce el complejo HLA + péptido
antigénico. Por eso, para que haya unión entre la célula T y la célula
infectada, TCR ha de reconocer tanto a la proteína HLA presentadora como al
péptido que ésta
contiene en su bolsillo, si no se dan estas dos condiciones la unión no se produce. Este reconocimiento combinado del péptido y la molécula HLA se denomina restricción por HLA, porque se restringe la capacidad de la célula T para reconocer al antígeno. Esto explica la grandísima especificidad de los linfocitos T.
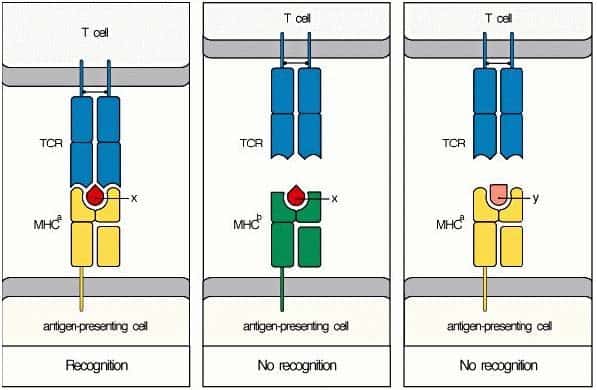
(Reproducido de Murphy K et al. (2008) Janeway’s Immunobiology (7th Ed.) Garland Science, Nueva York.)
Antígenos HLA de clase II
Los antígenos HLA de clase II son heterodímeros constituidos por dos glicoproteínas codifica- das por genes de la región de clase II del MHC, situado en el brazo corto del cromosoma 6. La cadena pesada α (34 kD) es codificada por los genes A, y la cadena ligera β (29 kD) es codificada por los genes B (Figura 9.5). Ambas cadenas son transmembranales y se asocian mediante enlaces no covalentes tras su síntesis independiente en el retículo endoplasmático rugoso.
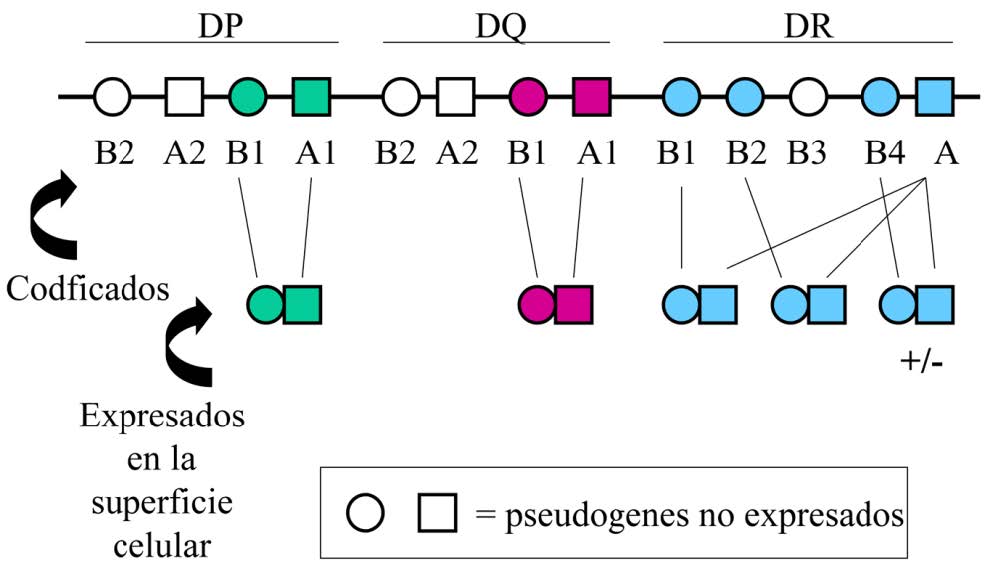
Para cada uno de los diferentes antígenos HLA de clase II (HLA-DP, HLA-DQ y HLA-DR) existe un gen A y un gen B. Una excepción a esta regla es la constituida por las proteínas HLA- DR, cuyo sistema es más complejo, existiendo al menos 3 genes HLA-DRB en los diferentes cromosomas 6. Así, se expresan múltiples loci de Clase II (hasta 8 en humanos) (Figura 9.6):
- DPA1, DPB1
- DQA1, DQB1
- DRA, DRB1, DRB2, DRB4
Los antígenos HLA de clase II se expresan en células presentadoras de antígenos (APCs) profesionales y en células del estroma del timo de forma constitutiva (Figura 9.7).
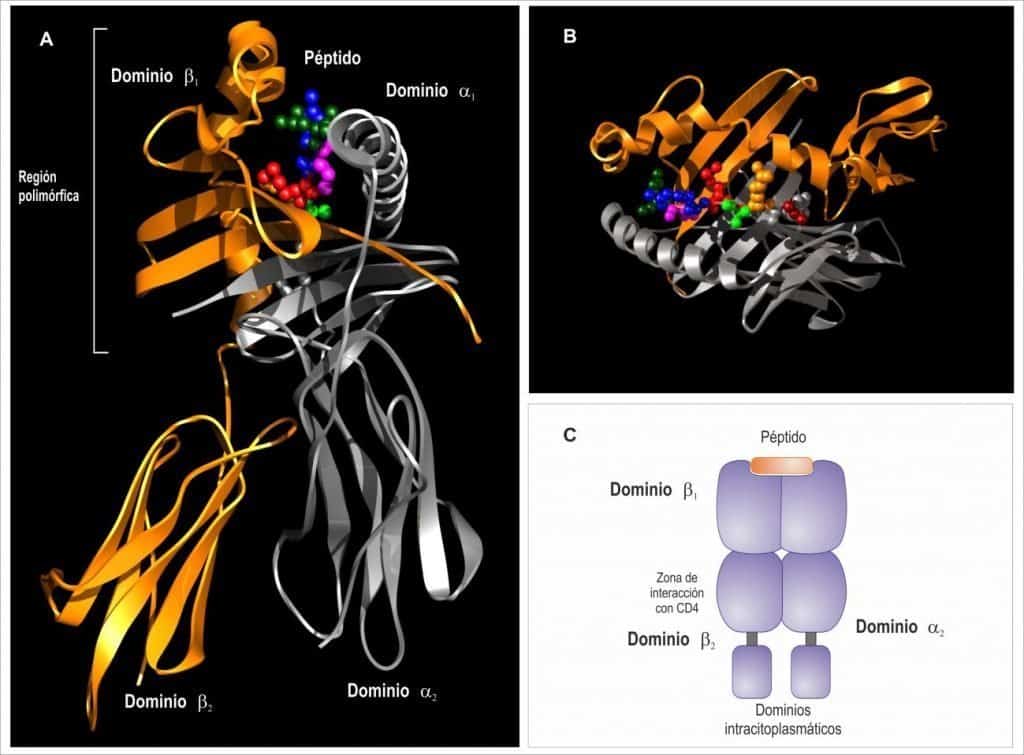
(A) Las moléculas de clase II están formadas por dos cadenas transmembrana muy similares de- nominadas cadena α y β. (B) Los dominios α1 y β1 forman una región que une péptidos denomi- nada hendidura peptídica que interacciona con TCRαβ. (C) El dominio β2 interacciona con el correceptor CD4 por donde se indica. (Reproducido de Regueiro J.R., López C., González S. & Martínez E. (2011) Inmunología. Biología y Patología del Sistema Inmune. (4ª Ed.) Editorial
Médica Panamericana, Madrid.)
(Reproducido de Murphy K et al. (2008) Janeway’s Immunobiology (7th Ed.) Garland Science, Nueva York.)
Además, se pueden expresar de forma inducible en otros tipos celulares como el endotelio vascular o los fibroblastos, bajo la acción de determinadas señales como el IFN-γ (Figura 9.7). Por ello, su expresión está mucho más restringida que la de los antígenos HLA-I. Su función es mostrar antígenos exógenos, que han seguido la vía endocítica, a los linfocitos T cooperadores, activándolos. Estos linfocitos producen citocinas que actúan sobre distintas células diana.
Al igual que los antígenos HLA de clase-I, los antígenos HLA de clase-II son muy polimórficos. El sistema HLA, por tanto, es un complejo sistema genético con múltiples loci y muchos alelos diferentes en cada uno. Todos los genes tienen un elevado polimorfismo a excepción de HLA- DRA que tiene un único alelo. En la siguiente imagen se muestran los diferentes genes para antígenos HLA de clase II. Obsérvese que en algunos casos los genes no son funcionales (pseudogenes) (Figura 9.6). Estas propiedades (poligenia y elevado polimorfismo) permiten que las APCs expresen en su superficie una gran variedad de moléculas HLA de clase II, lo que les permitirá presentar un elevado número de diferentes péptidos a los linfocitos T cooperadores.
Cada una de las cadenas de los antígenos de clase II consta de dos dominios (Figura 9.5):
- Los dominios proximales a la membrana (α2 y β2) tienen un plegamiento característico y pertenecen a la superfamilia de las inmunoglobulinas.
- Los dominios distales a la membrana (α1 y β1), construyen con su plegamiento un hueco físico de unión a péptidos.
El diagrama de cintas permite apreciar que los dominios α1 y β1 forman una cavidad o bolsillo de unión de péptidos de la misma manera que en las moléculas HLA-I, solo que en este caso dicha estructura se conforma con 2 proteínas diferentes unidas no covalentemente. Para ello, dichos dominios α1 y β1 se pliegan en una zona plana formada por láminas β antiparalelas sobre las que reposan dos α-hélices (una de cada proteína). De la misma manera que en las moléculas de clase I, si este bolsillo o cavidad física no está rellena con un péptido antigénico, las proteínas HLA de clase II no se pueden expresar en superficie. La principal diferencia con los antígenos HLA de clase-I es que, en las moléculas HLA de clase-II, el bolsillo es más flexible al estar formado por dos proteínas; en los Ag de clase I es una estructura más rígida al estar formada por una única proteína. Esto determina el tipo de péptido que se puede unir a cada una de las dos moléculas.

Responses